Hallo Helmut
[quote pid='324875' dateline='1464808781']
Hast Du da vielleicht noch Fotos von stärker vergrößerten Zystiden in KOH (3-5%), Thorben?
[/quote]
Also bei mir reagieren alle Zystiden wie in diesem Thread hier.
KOH 3%
23.
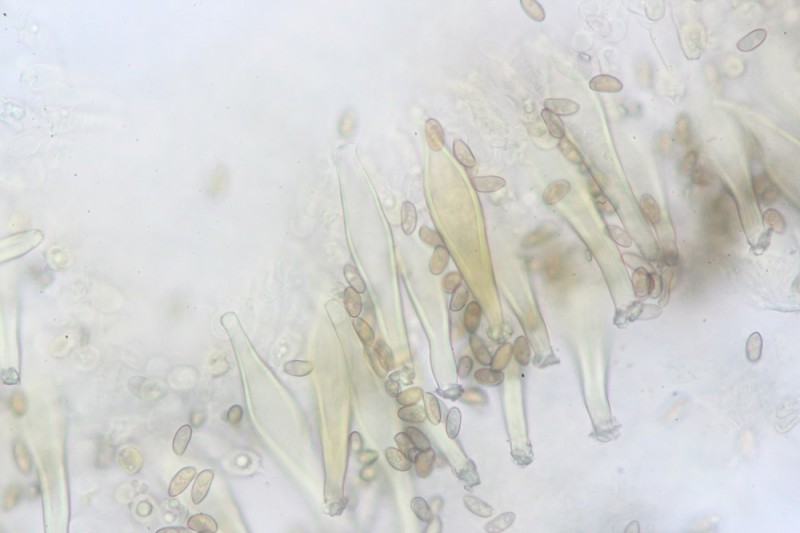
24.
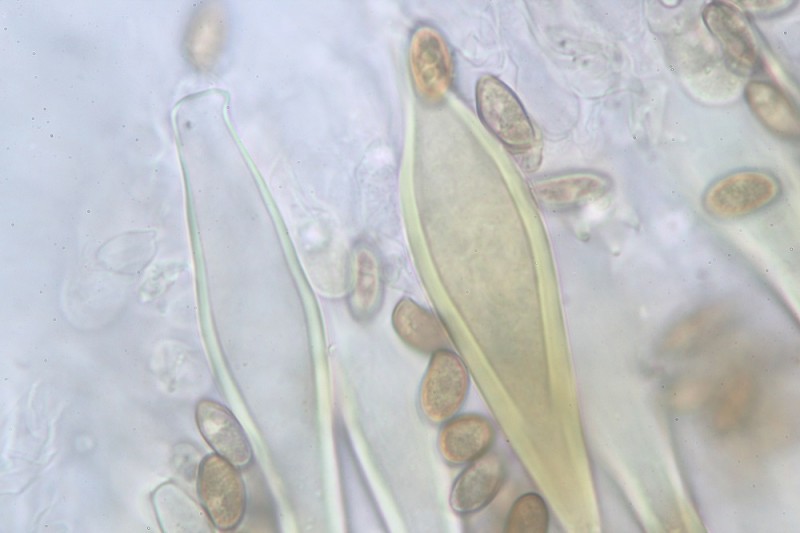
Ansonsten hätte ich noch braune Zystiden
25.
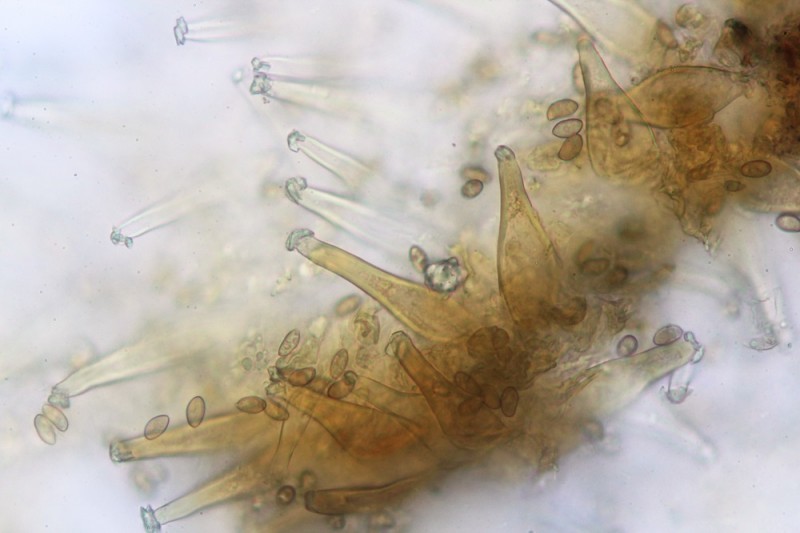
Zitat
Und die Kaulos gehen bis zur Stielbasis (hast Du dort auch gesucht, Thorben ?)
Geguckt hatte ich und konnte nichts erkennen, aber versuche es einfach noch einmal, vielleicht habe ich ja etwas übersehen.
Zitat
Und da bin ich wieder beim Einzelfruchtkörper. Um so etwas Außergewöhnliches abzusichern, sollte schon eine schöne Kollektion vorliegen mit jüngeren und älteren Frk.
Vielleicht kommen noch ein paar Exemplare nach, Thorben.
Momentan ist es hier am Regnen, weshalb die Chancen ganz gut stehen neue Fruchtkörper zu bekommen. Sollten allerdings keine Fruchtkörper mehr in diesem Jahr kommen, dann gibt es sie sicherlich im nächsten Jahr 
So jetzt schaue ich mir die Stielbasis noch mal genauer an 
VG : Thorben
[hr]
Kleine Korrektur:
Die Stielbasis besitzt doch Kaulozystiden 
Stielbasis Kaulos:
26.

27.
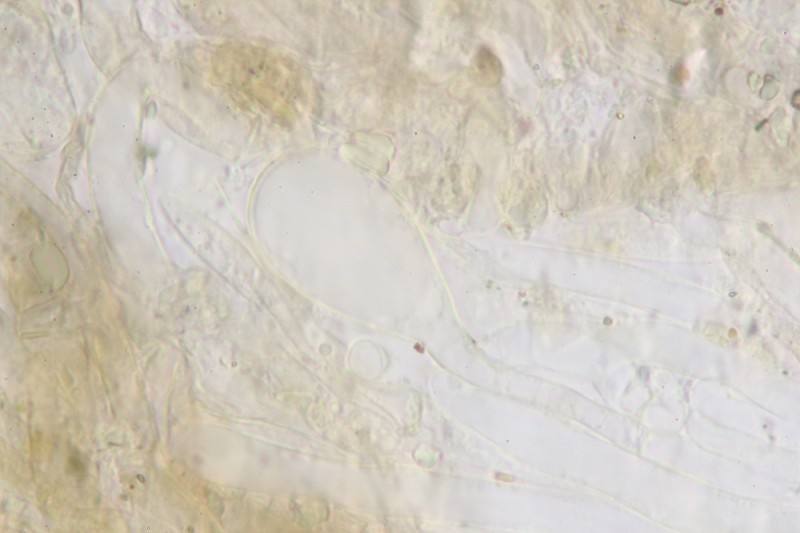
28. Und schon wieder Braun 
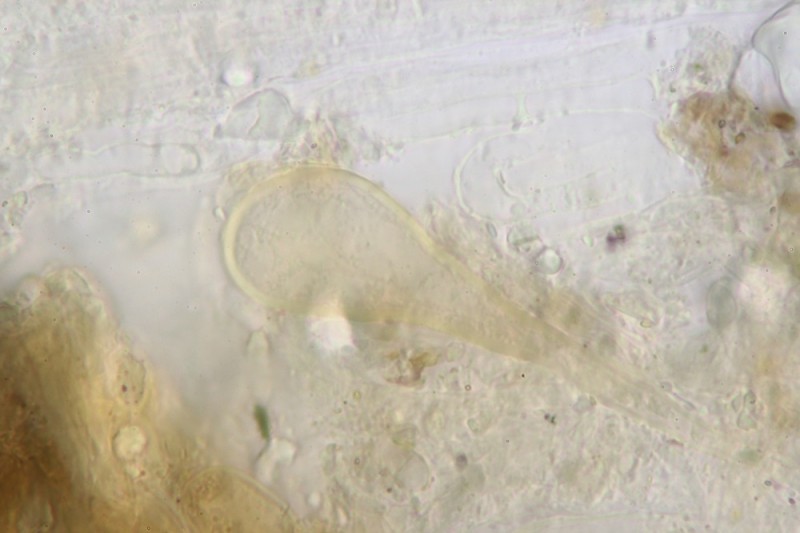
Was meint ihr soll ich den Pilz jetzt trocknen oder noch bis morgen am Leben halten ?
VG : Thorben




 Ich sehe das oft auch ohne den Einsatz von KOH. Das scheint auch bei sehr leicht basichen Lösungen zu funktionieren. Trotzdem hat Pablo recht. Deswegen habe ich nach KOH als Mikroskopierlösung gefragt.
Ich sehe das oft auch ohne den Einsatz von KOH. Das scheint auch bei sehr leicht basichen Lösungen zu funktionieren. Trotzdem hat Pablo recht. Deswegen habe ich nach KOH als Mikroskopierlösung gefragt. Ich kann leider nur auf den Stangl: Inocybe in Bayern, GPBW Band 5 und die Funga Nordica verweisen.
Ich kann leider nur auf den Stangl: Inocybe in Bayern, GPBW Band 5 und die Funga Nordica verweisen.