Hallo,
ich möchte wieder einmal Phlegmatien aus der Sektion Fulvi vorstellen.
1) Fund im Eichendominierten Mischwald auf Muschelkalk (Eichen, Elsbeere, Buchen, Hasel, Kiefer). Ein großer stämmiger Fruchtkörper mit gelbgrünlichem Hut (eine Farbe, die meine Kamera wieder einmal schlecht eingefangen hat), in der Hutmitte rotbräunlich, fast schorfig wirkend; Hutrand heller und gelb mit grünlicher Note.
Lamellen gelblich mit leicht grüner Note gefärbt.
Stiel gleichsam gelblich grünlich, recht dick; Knolle nur mäßig ausgeprägt.
Fleisch im Hut und Knolle gelbweißlich, ebenso in der Mitte des Stiels, an der Stielhaut aber auffällig und lebhaft gelbgrün.
Geruch nicht markant, Geschmack nicht getestet.
KOH auf dem Hut grünlich, Stiel + Knolle + Mycel negativ. Im Fleisch (Hut, Knolle) aber nach einigen Minuten lebhaft weinrot.
Sporen 11,5 x 6,9µm; Q = 1,67; recht grobwarzig. Wie würde man die Sporenform bezeichnen?
Mit diesen Eigenschaften komme ich zu C.auricilis, dem Rotreagierenden Steineichen-Klumpfuß. Aufgrund der der intensiven KOH-Reaktion im Fleisch kommt eigentlich gar nichts anderes in Betracht?




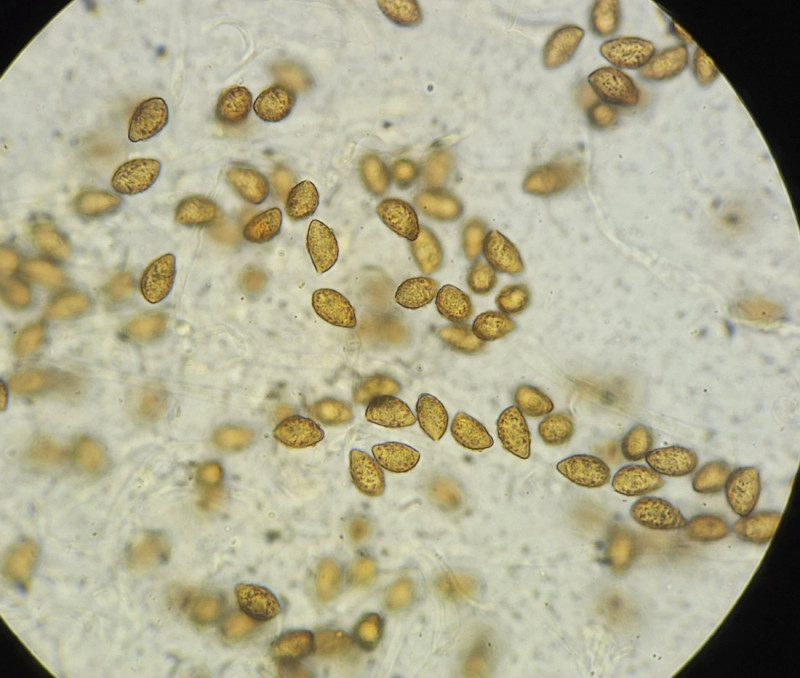
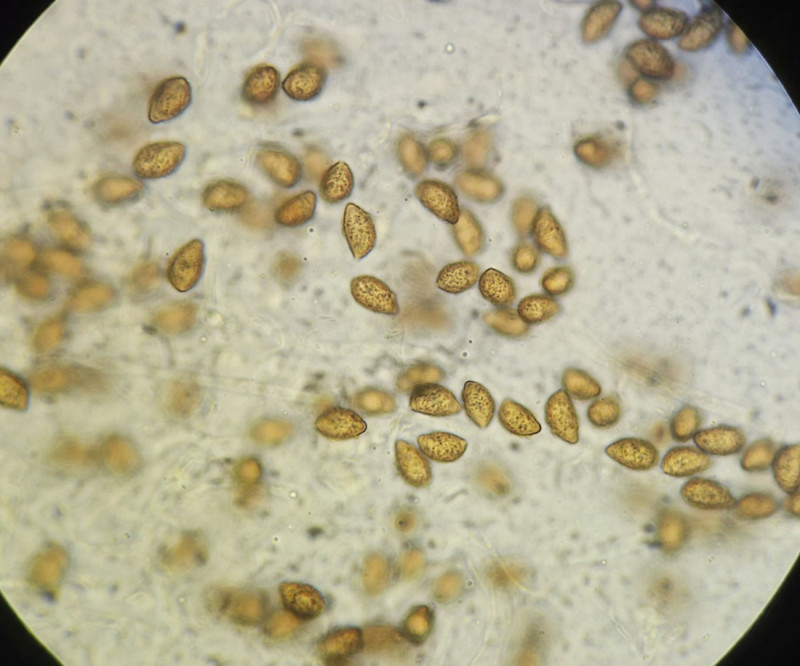
2) Fund im gleichen Wald wie 1. Der bereits etwas ältere Fruchtkörper war recht groß und ockerlich gefärbt, hatte aber eine leichte grünliche Note; Hutmitte bräunlich. Im äußeren Bereich des Hutes sind eingewachsene Fasern zu erkennen. Lamellen gelblich mit leichter grünlicher Note.
Stiel grünlich gelb, ebenso die ausgeprägt gerandete Knolle; Knollenunterseite im Schnitt dreieckig.
Fleisch gelblich mit leichtem Grünton, in Hut und Knollenfleisch heller.
Geruch nichtssagend, Geschmack nicht getestet.
KOH auf Hut und Knollenrand bräunlich, im Fleisch gräulich mit ganz zarte rötlicher Note.
Sporen 12,2 (11 - 13,5) x 6,7 (6 - 7,5); Q = 1,82; grobwarzig, zitrionenförmig?
Ich lande beim Schlüsseln bei C.quercilis, dem Steineinchen-Klumpfuß. Das würde auch gut zum Habitat passen.




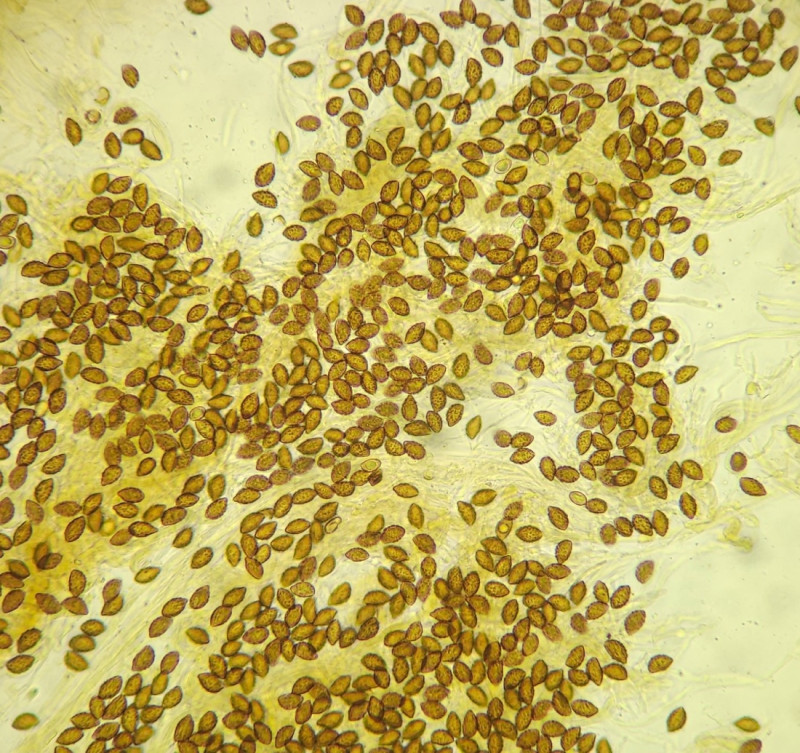

3) Fund im Laubwald auf Muschelkalk, vor allem Eiche, Elsbeere und Buche; direkt am Wegrand, in einer Gruppe aus ca 8 FK.
Statur realiv groß und kräftig. Hut ockerlich mit grünlichem Einschlag gefärbt, bei älteren Fruchtkörpern eher bräunlich. Hutrand behangen mit Velum. Lamellen gelblich mit grüner Note.
Stiel grün-gelblich, Knolle breit und gerandet, Knollenunterseite wie bei 2. im Schnitt dreieckig. Bei einem älteren FK Knollenrand mit ockerlichem Velum beklebt.
Fleisch gelb-grünlich. Geruch nichtssagend, Geschmack nicht getestet.
KOH auf Hut bräunlich, im Fleisch gräulich mit ganz zart roter Note.
Sporen 12,4 (11 - 14) x 7,2 (6,5 - 7,5); Q = 1,72; grobwarzig, zitrionenförmig bis mandelförmig?
Obwohl an einer anderen Stelle gefunden und optisch etwas anders als 2. lande ich erneut bei C.quercilis.





Zwei Meter weiter stand mutmaßlich ein älterer Fruchtkörper der gleichen Art. Die Bilder insbesondere vom Stiel und der Knolle sind hier viel realistischer als auf den anderen Bildern gelungen.



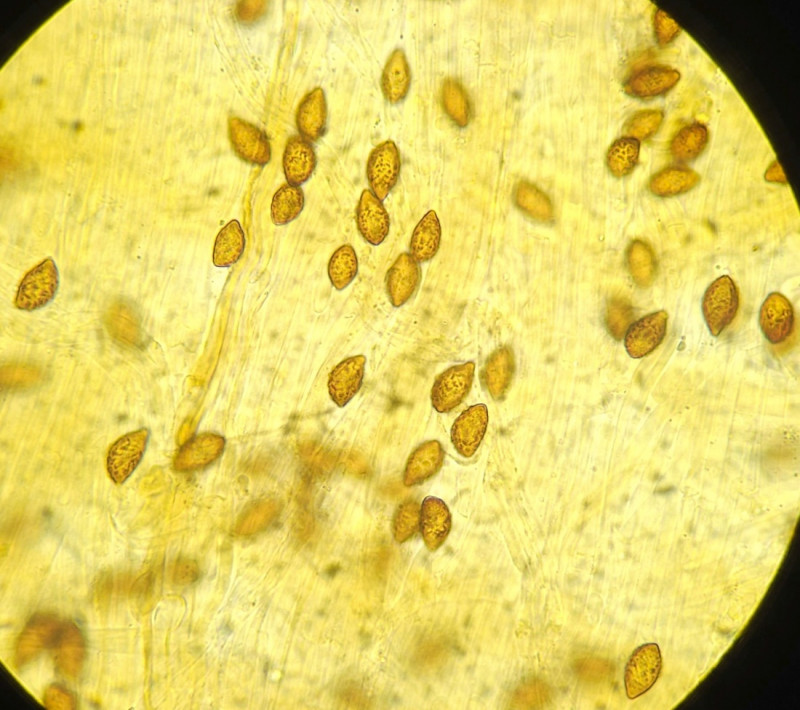
4) Fund ca 50m entfernt von 2. Sehr kleiner schmächtiger Fruchtkörper, zu 6cm hoch; Hutdurchmesser sicher keine 5cm.
Eigenschaften siehe Bild. Ich dachte zunächst sofort an C.splendens, aber das Fleisch war nicht leuchtend gelb durchgefärbt sondern wässrig grünlich gelb.
Geruch nichtssagend, Geschmack nicht getestet.
KOH auf dem Hut grünlich bräunlich, Knollenrand bräunlich, im Fleisch rosalich gräulich.
Sporen 12,1 (11,5 - 12,5) x 7,3 (6,5 - 7,5); Q = 1,81; grobwarzig, zitrionenförmig bis mandelförmig?
Mit der Sporengröße ist C.splendes oder C.citrinus raus. Wenn ich den Fund durchschlüssele lande ich erneut beim C.quercilis. Mich wundert allerdings der verglichen mit den obigen Funden äußerst zierliche Habitus. Kann das wirklich die gleiche Art sein?!







Wie immer die Bitte an unsere Cortinarienexperten Cortimarius , Mykollege_Günter und Werner Edelmann um ihre Expertise. Danke im Voraus!
![]()


