Hallo zusammen,
am letzten Sonntag traf sich der APR zur ersten Exkursion des Jahres am Botanischen Garten der Ruhr-Uni Bochum. Trotz Schnee und Eis konnte wir dabei einige Pilze finden, die ich hier zeigen möchte:
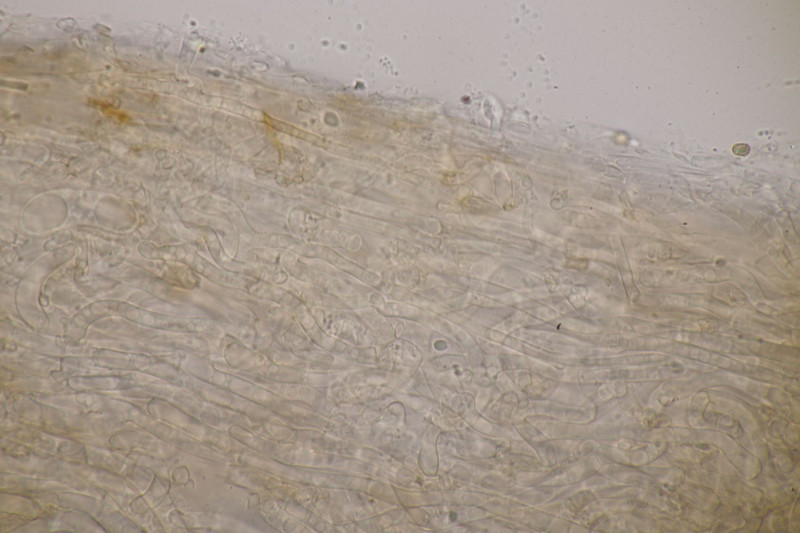
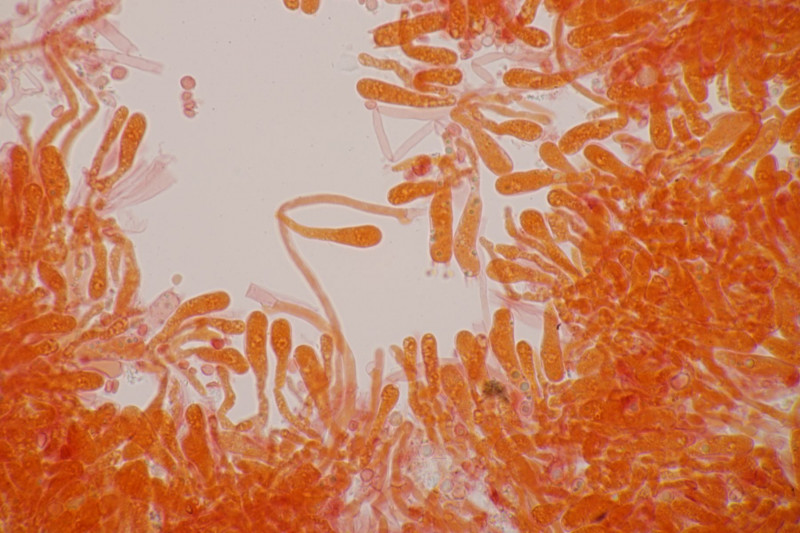
1. Ein Rindenpilz auf Laubholz, vermutlich Eiche, mit Sporen von 5,8±0,4 µm × 3,0±0,2 µm, Q=1,9±0,1, 5,1-6,8 µm × 2,7-3,4 µm, Q=1,7-2,1; Zystiden bis 150 µm lang. Schnallen sind nicht vorhanden, womit ich insgesamt zu Phanerochaete velutina tendiere. Was meinen die Expert:innen?



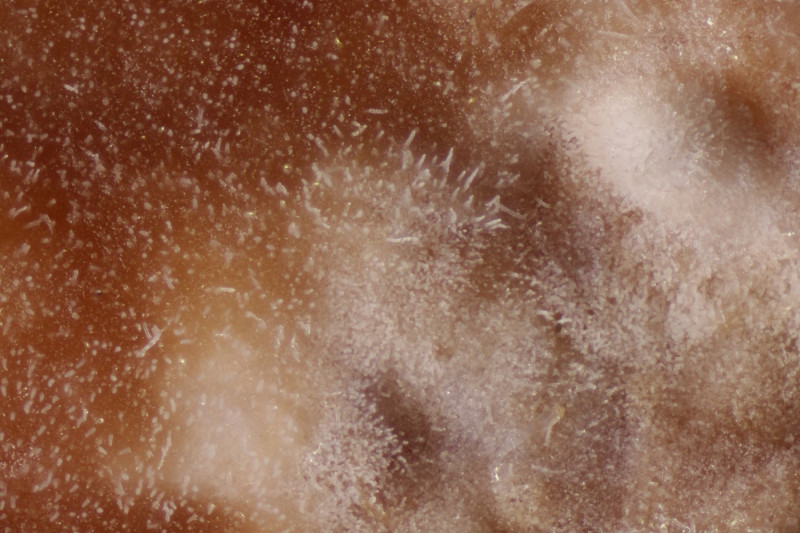

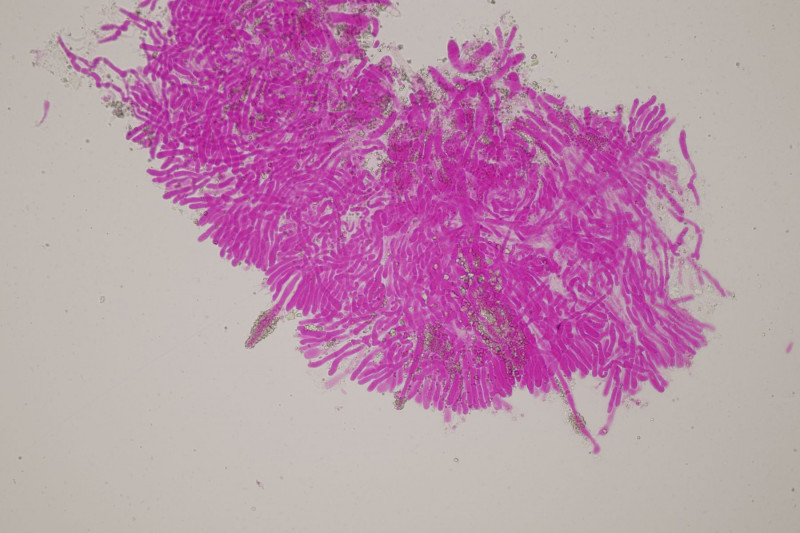
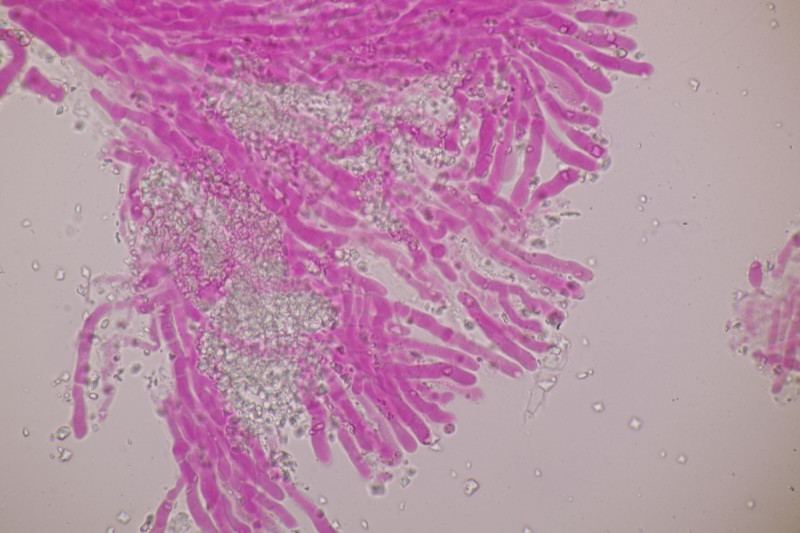
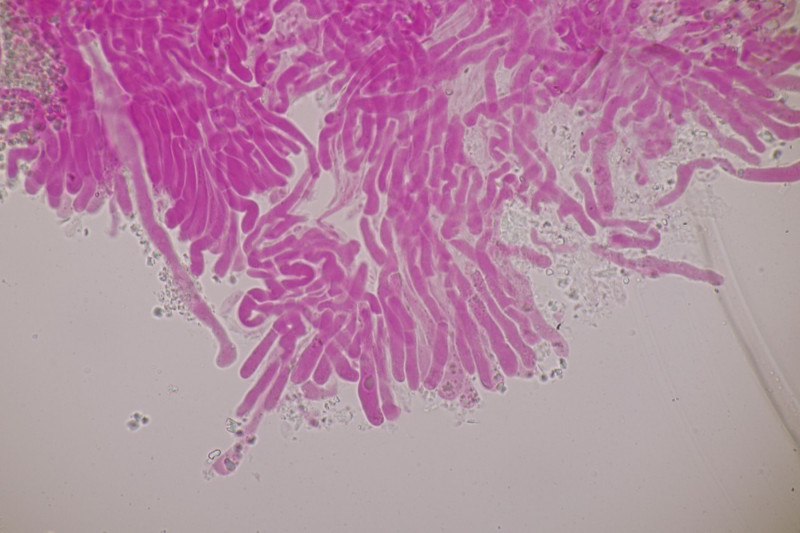
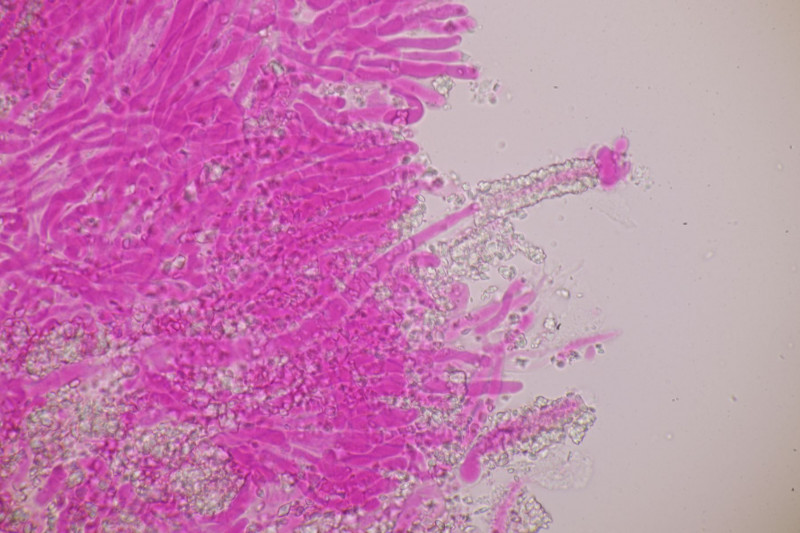
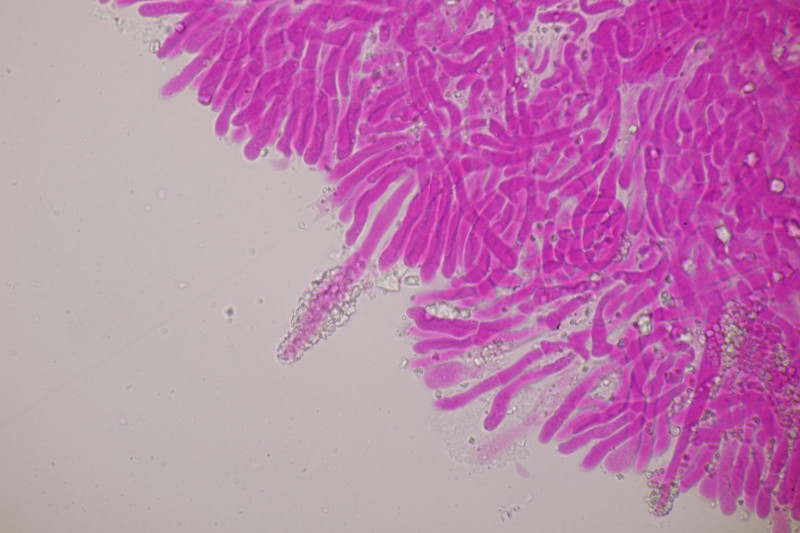
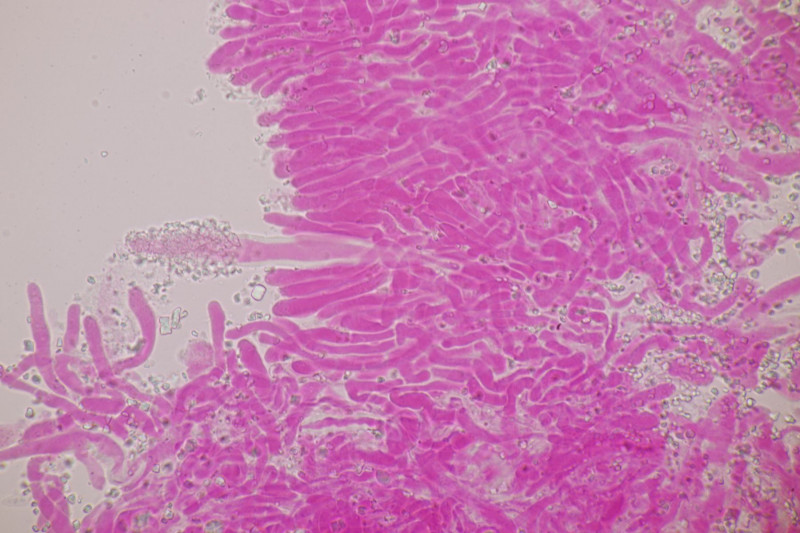
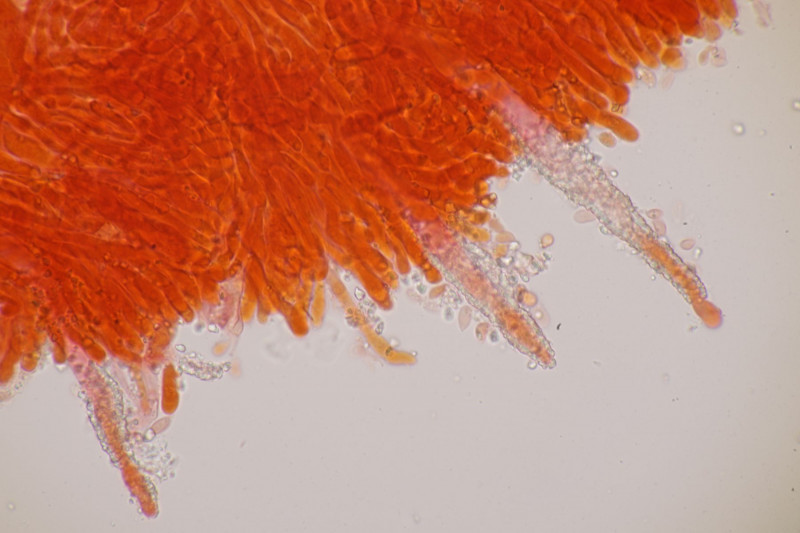
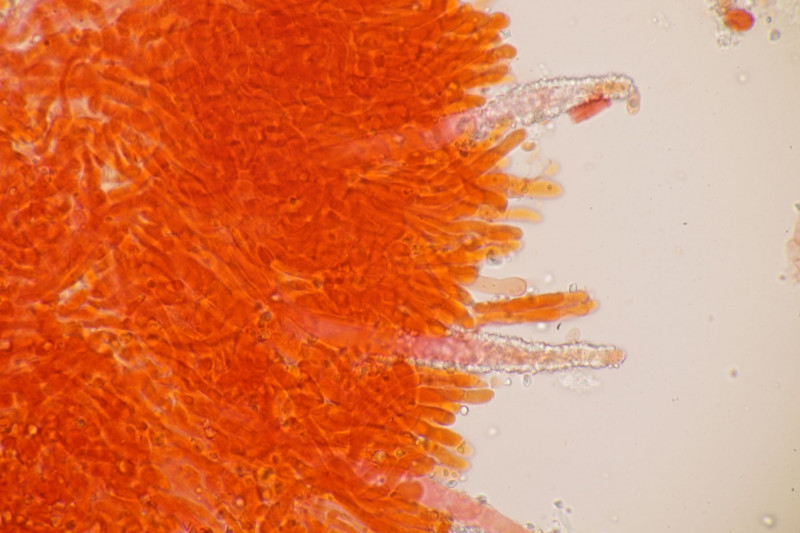
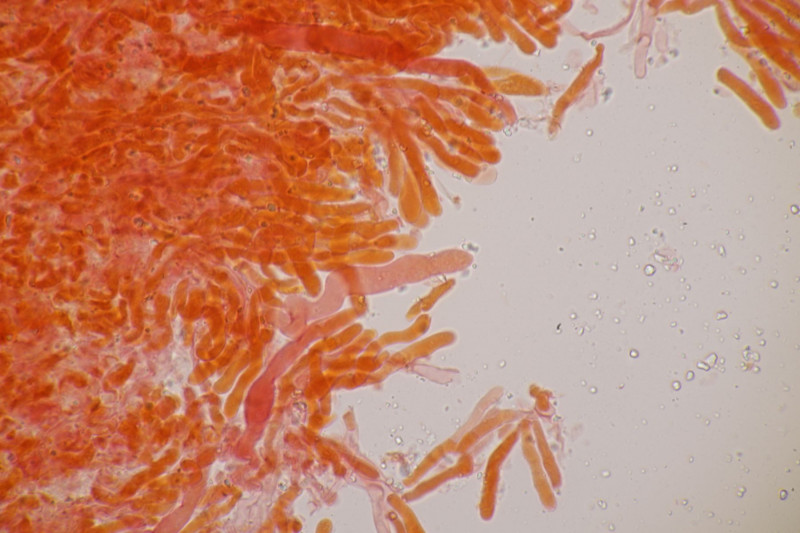
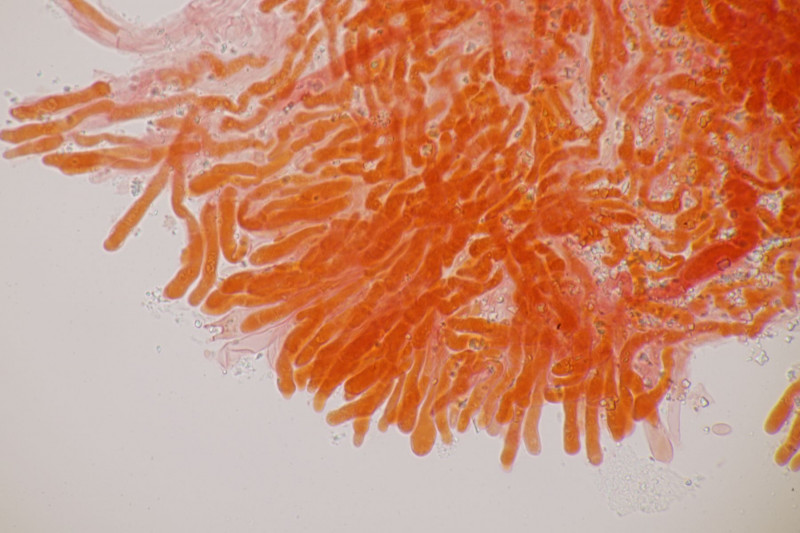
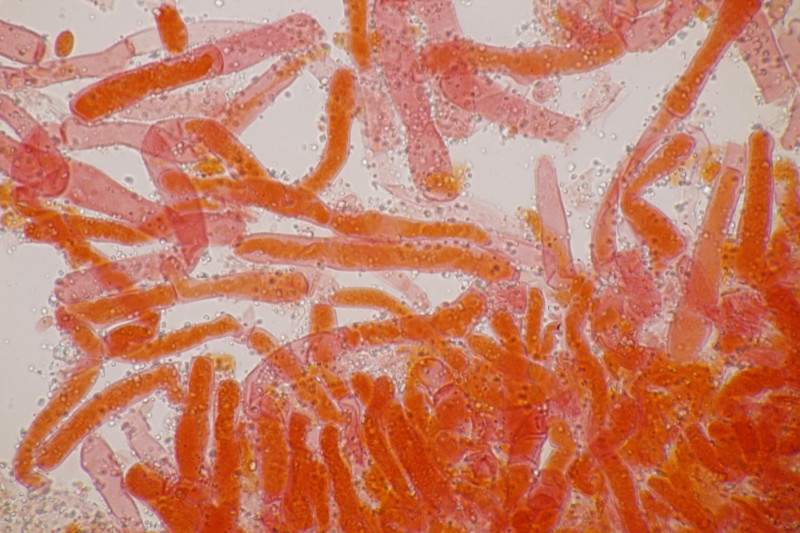
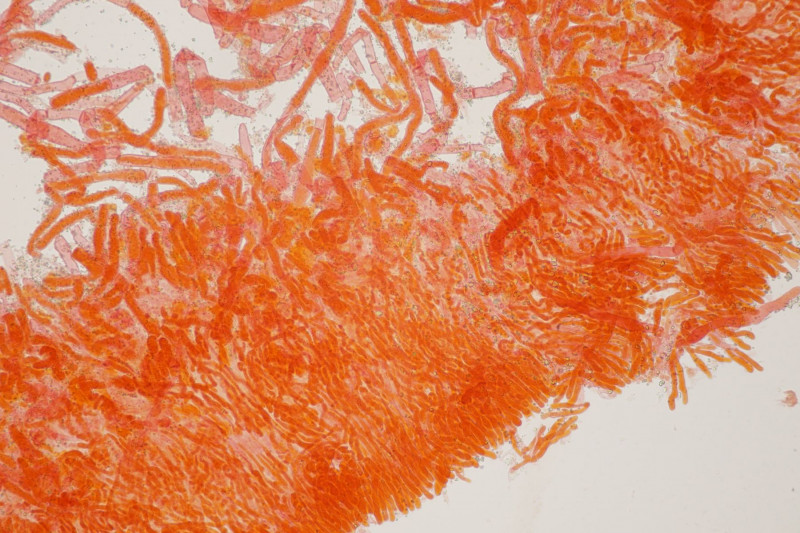
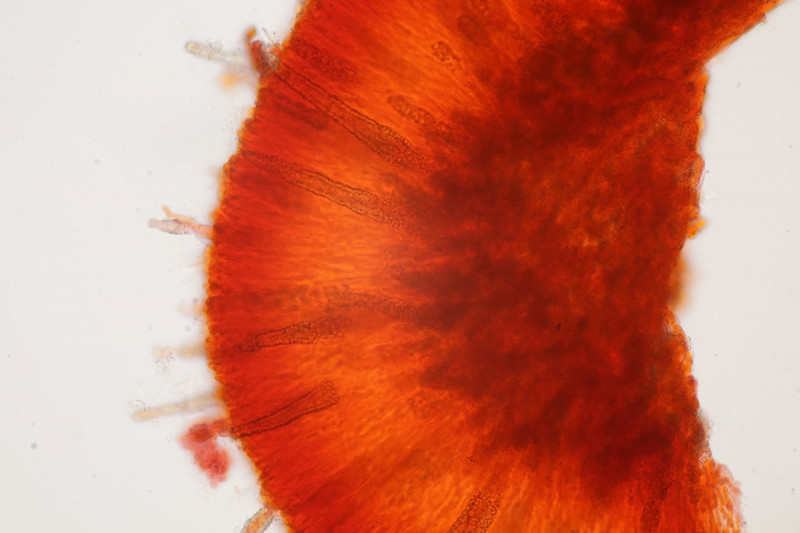
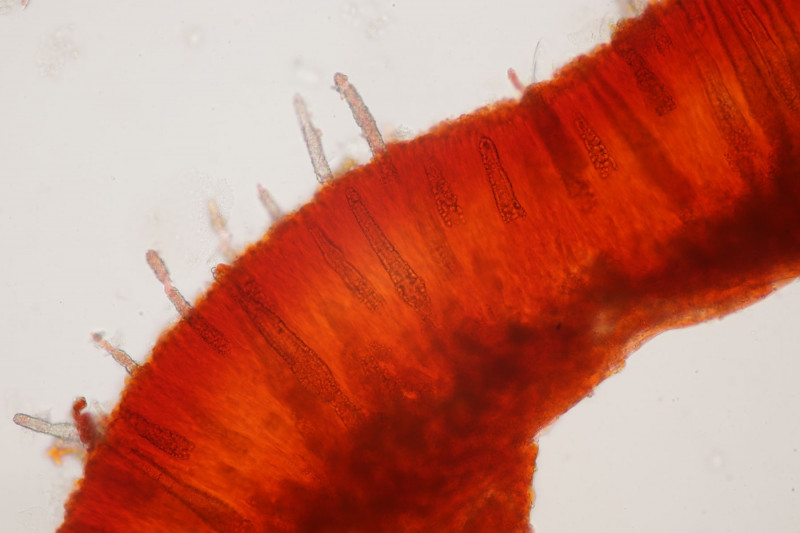
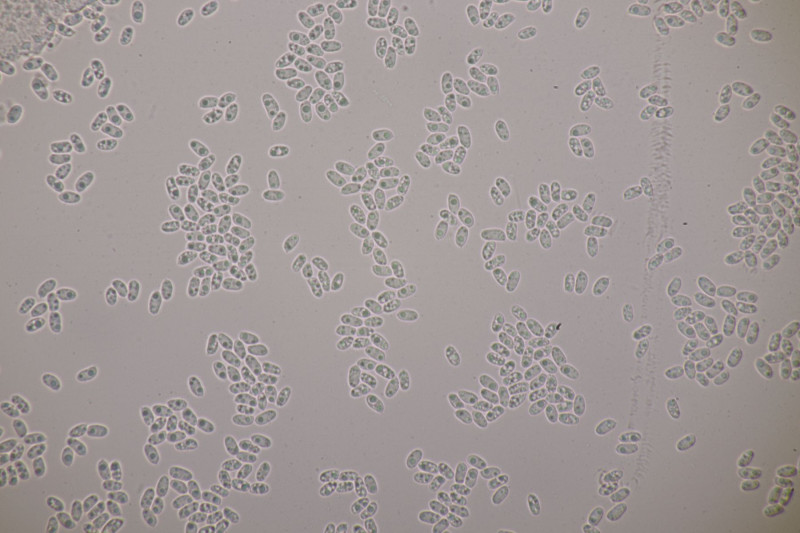
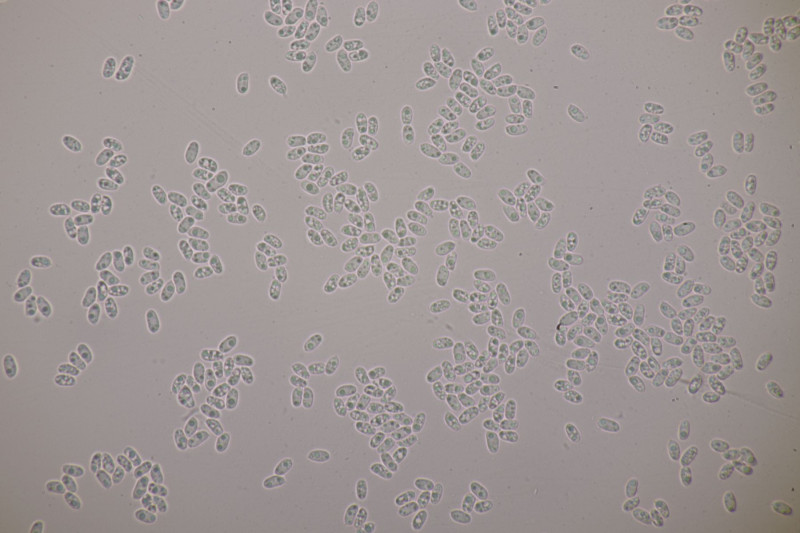
2. Obvidator quercinae ex Peniophora quercina

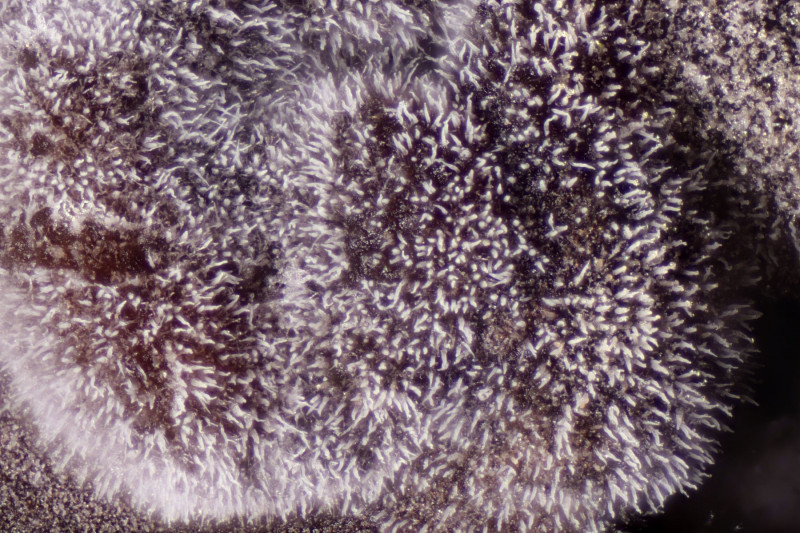

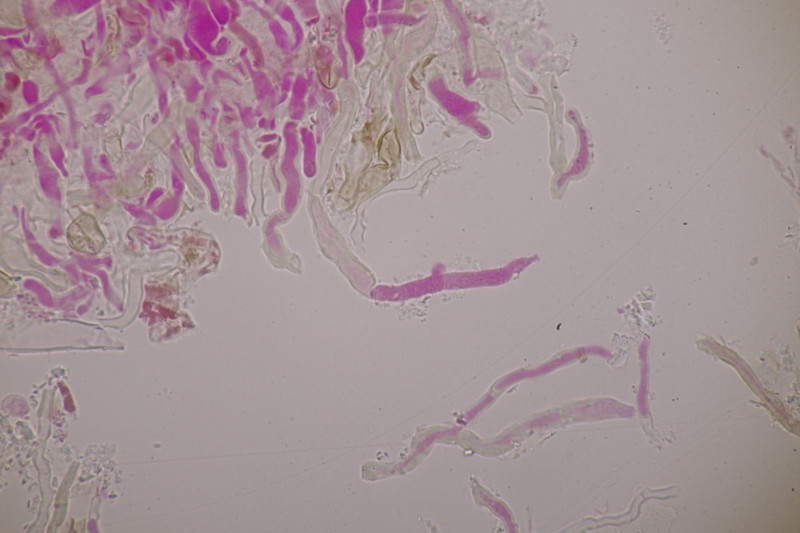
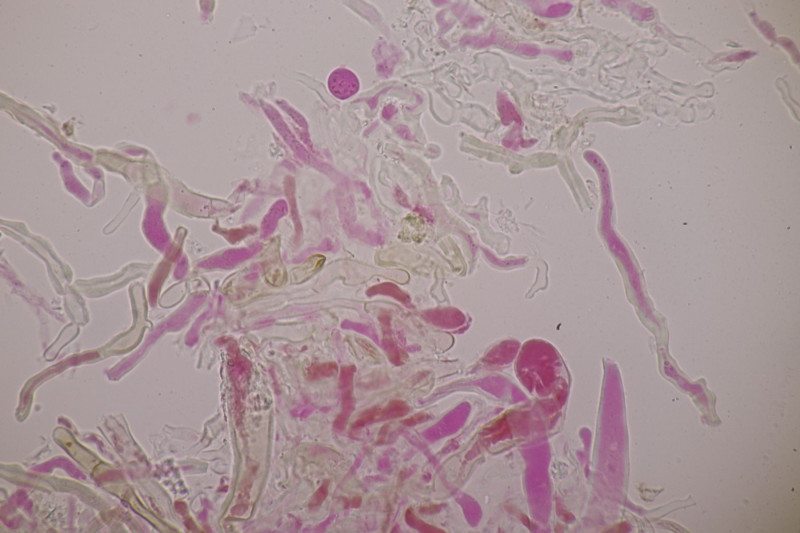
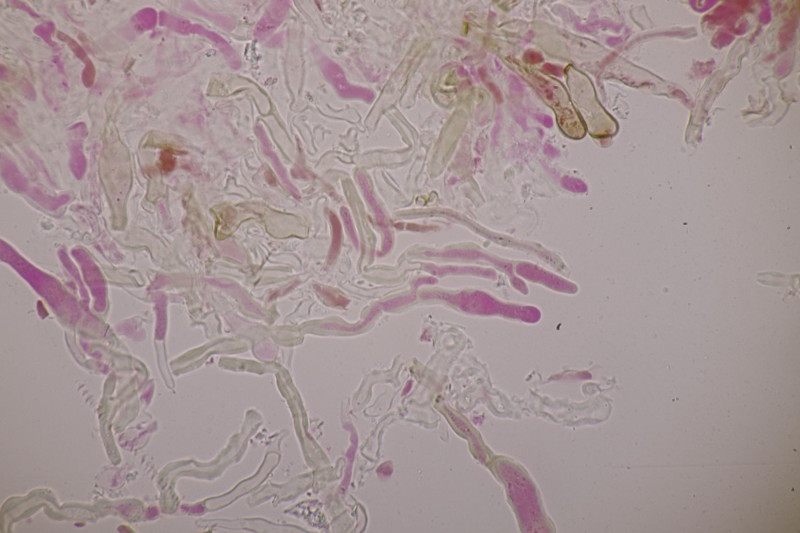
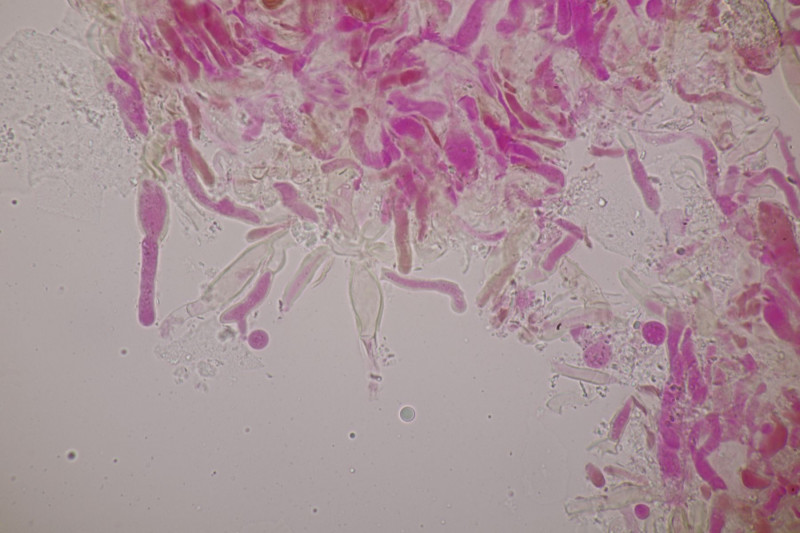
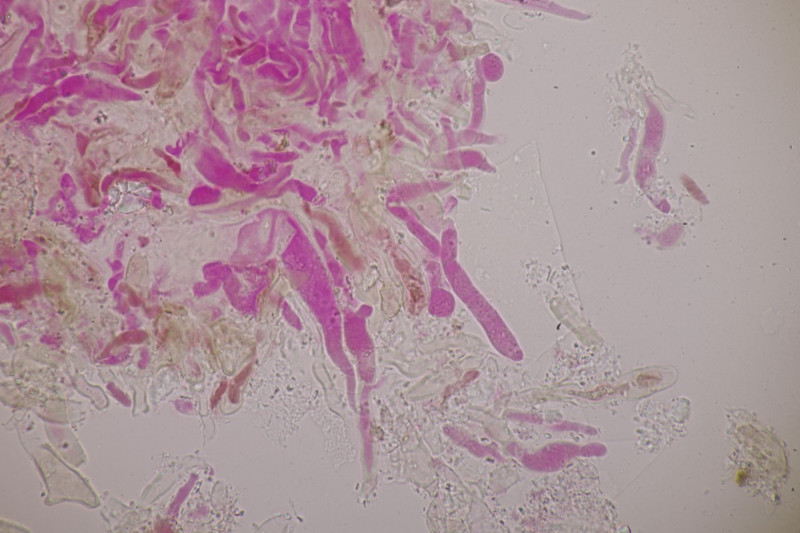
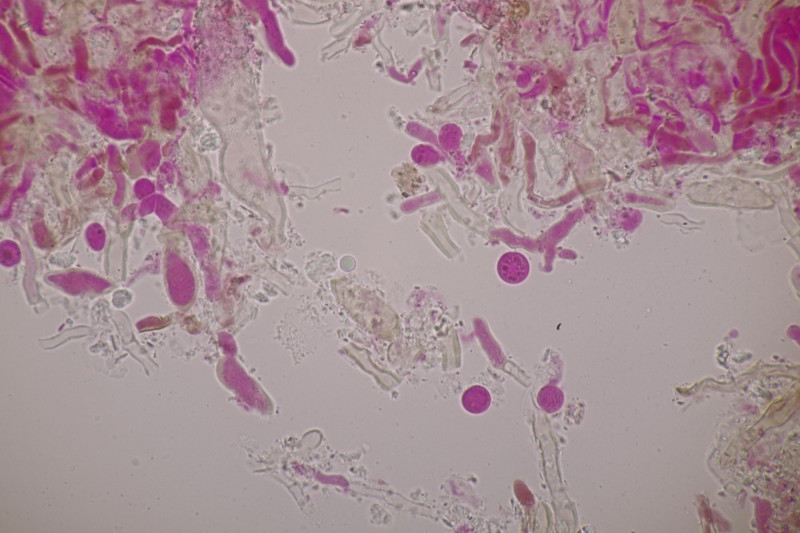
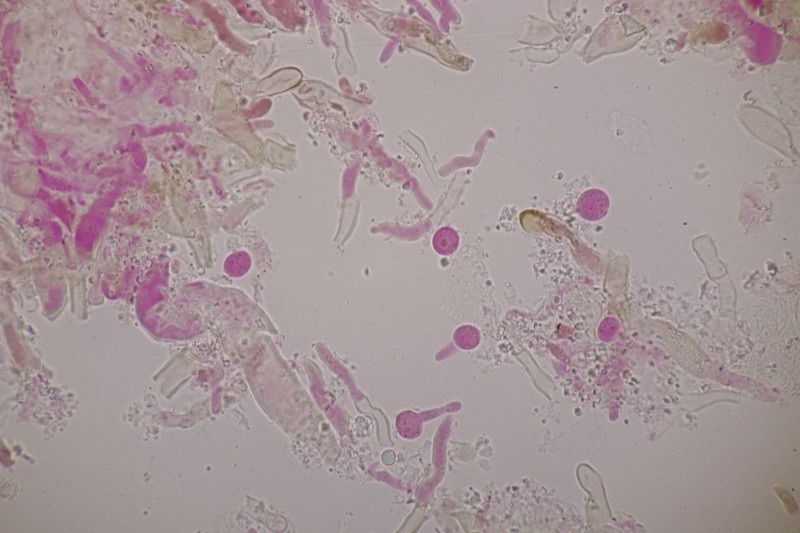
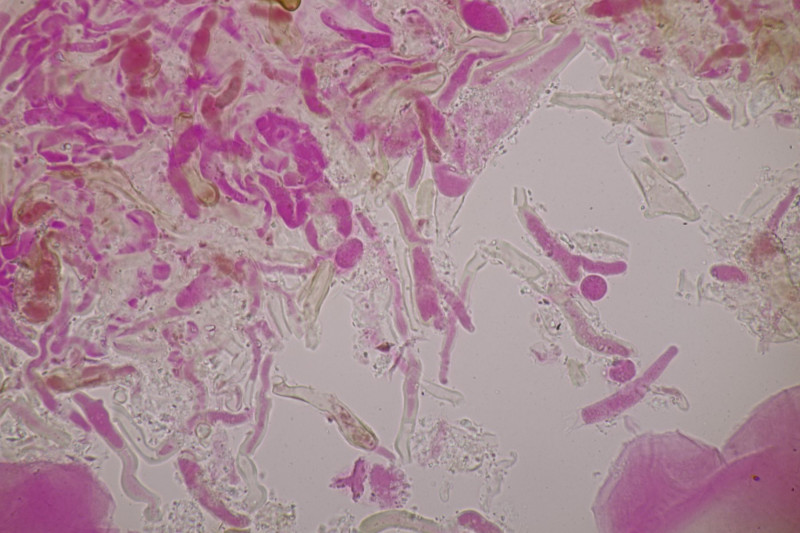
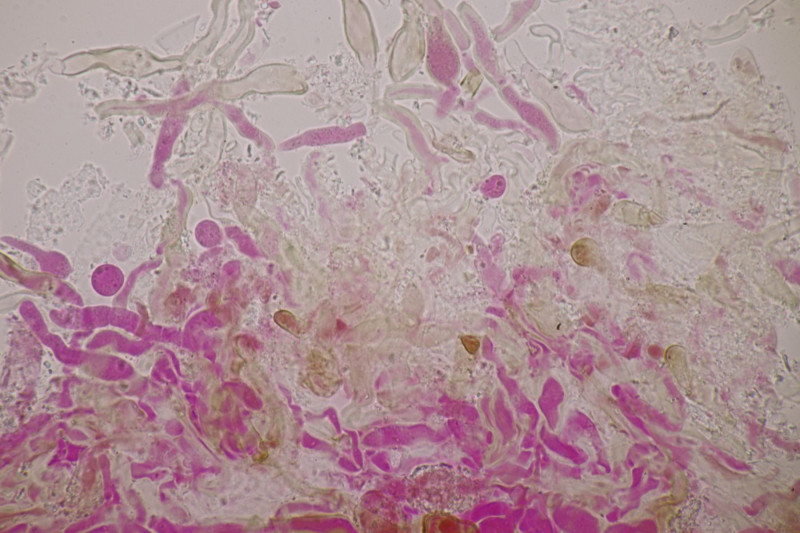
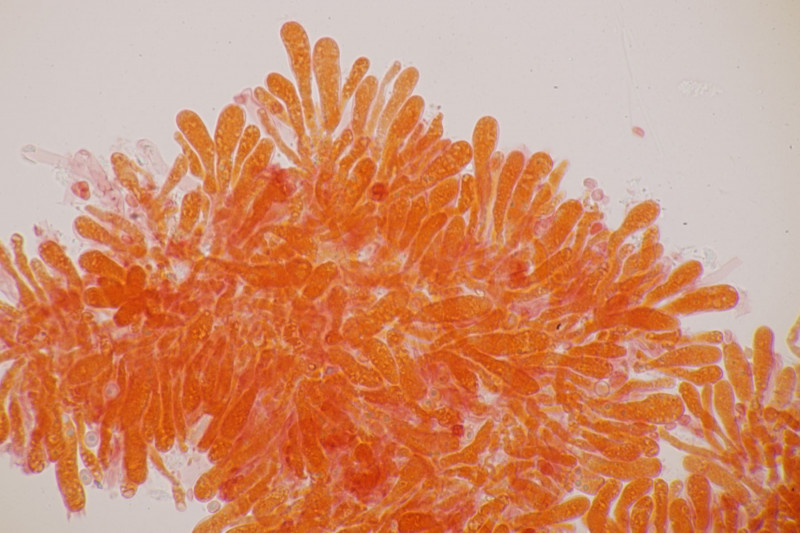
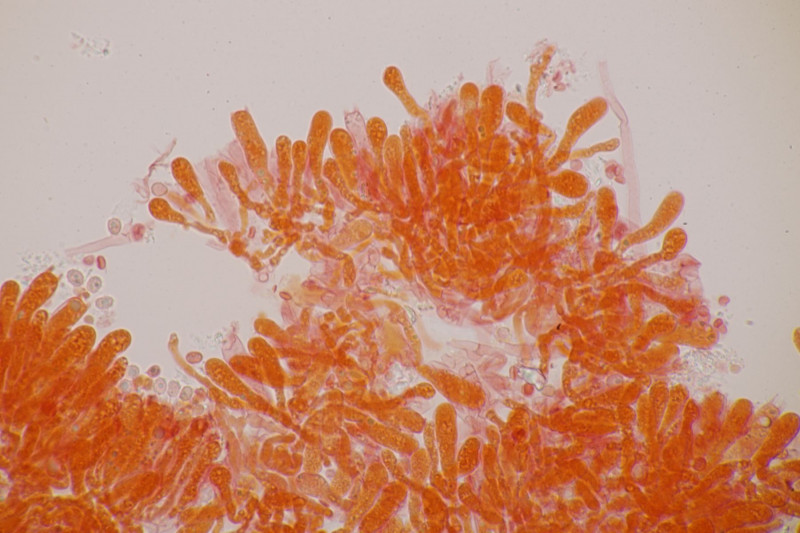
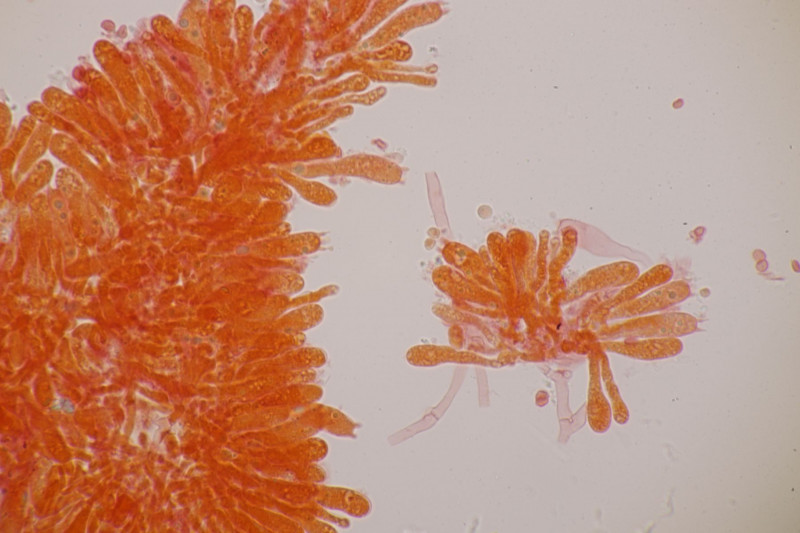
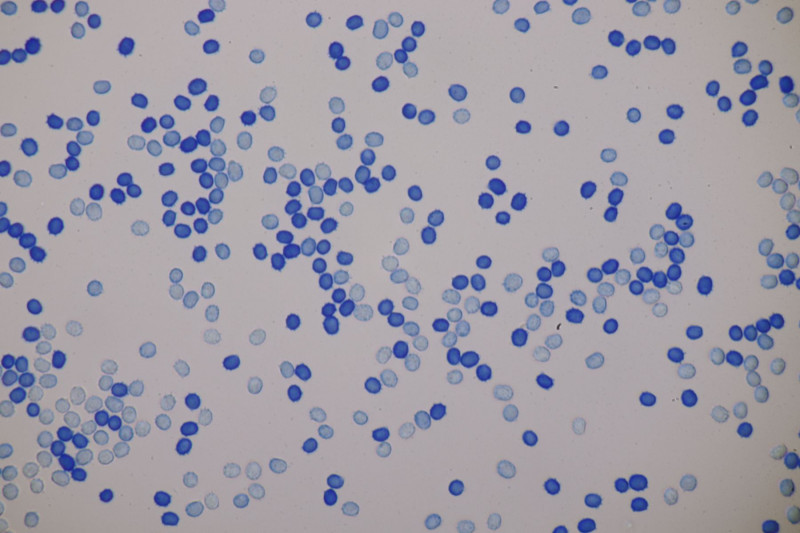
3. Crepidotus cesatii mit Sporen von 6,9±0,4 µm × 5,8±0,3 µm, Q=1,2±0,1, 6,2-7,6 µm × 5,2-6,2 µm, Q=1,1-1,3. Was mich etwas irritiert sind allerdings die sehr dünnen Cheilozystiden

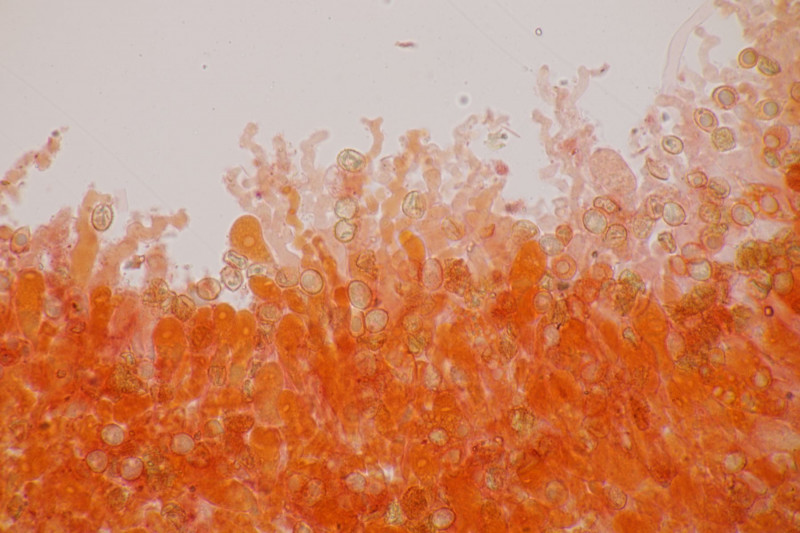
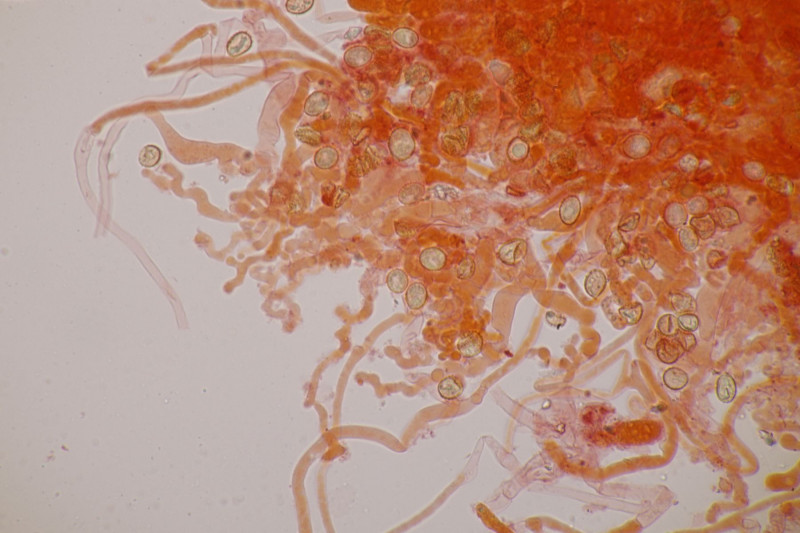
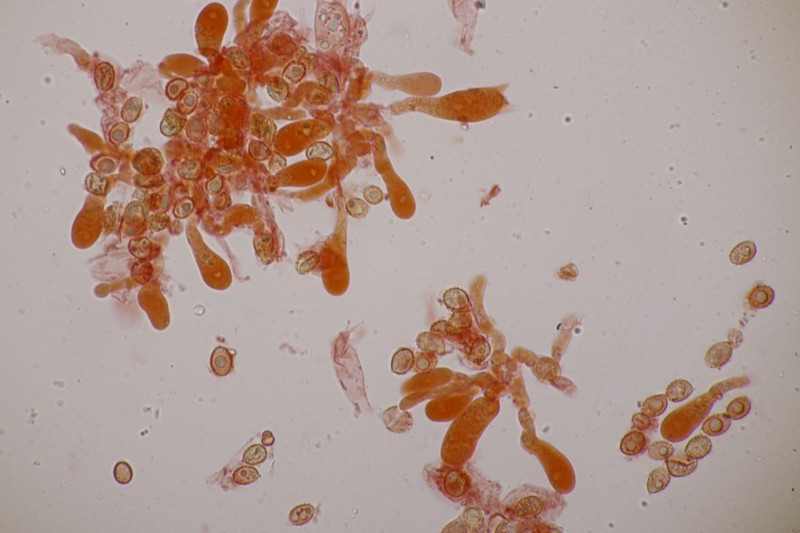
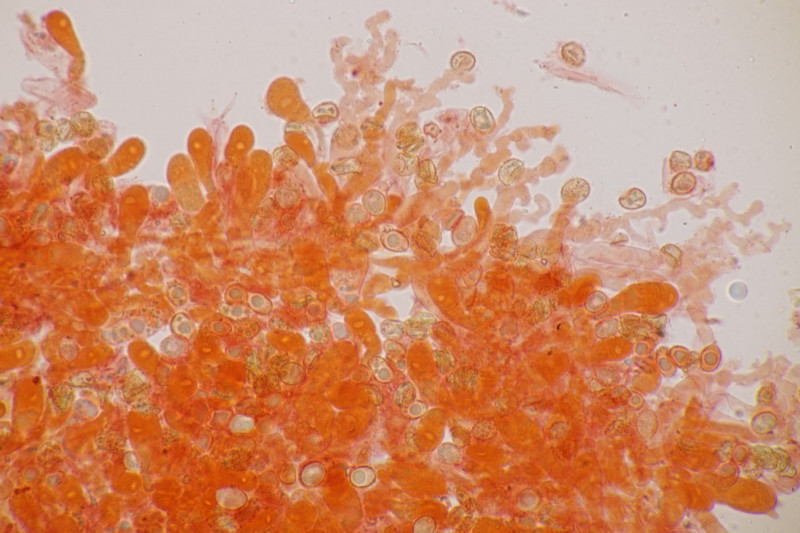
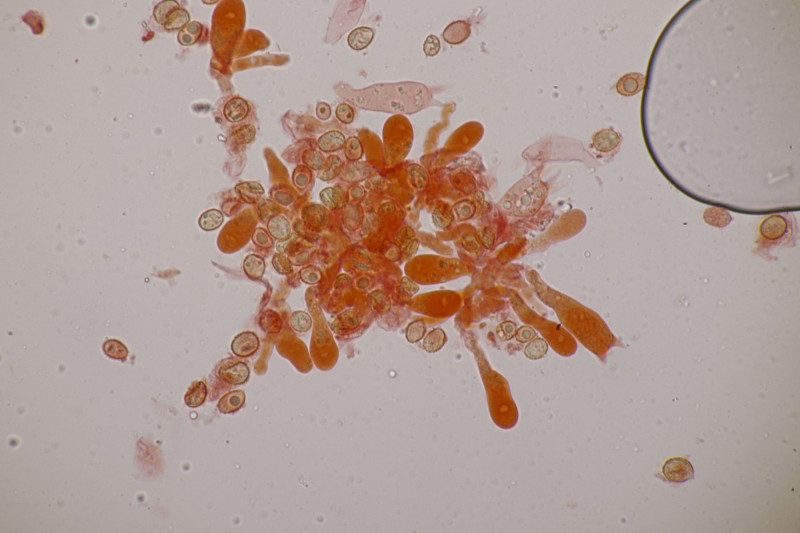
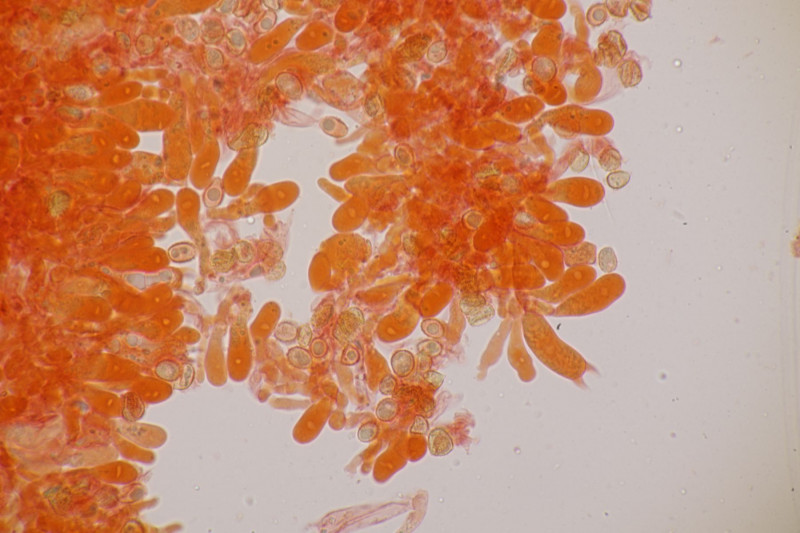

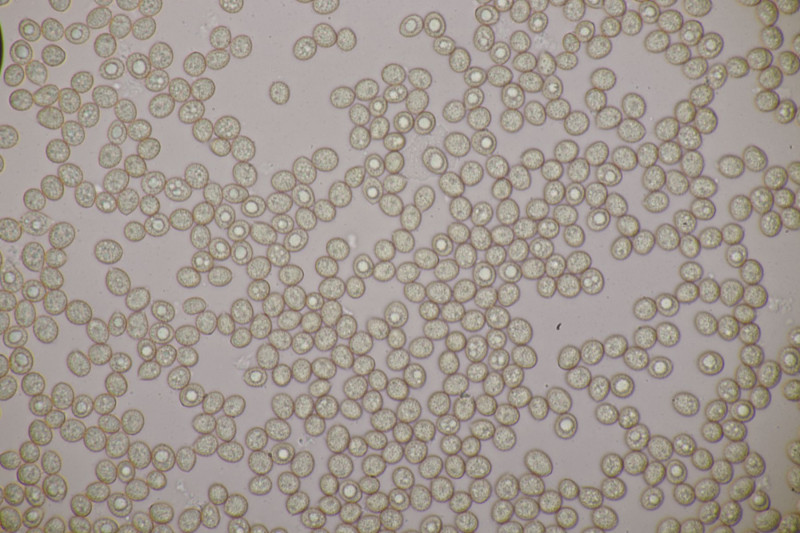

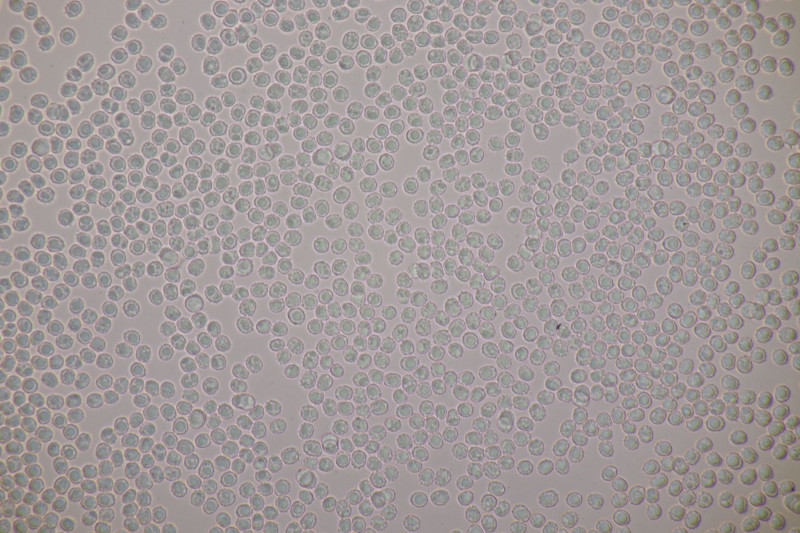
4. Hier wurde im Feld ein Kohlentrichterling vermutet. Zu Hause stellte sich dann aber erstmal heraus, daß der Pilz leicht süßlich-fruchtig riecht und keinen starken Mehlgeruch hat. Außerdem sind die Sporen ornamentiert und cyanophil. Damit wird es dann am Ende Lepista flaccida. Aber das zeigt mal wieder schön, daß man Pilze nicht anhand von Makrofotos bestimmen sollte.



Björn


