Servus beinand, servis Ingo - ingosixecho,
das Packerl ist bestens angekommen. Ich lag die letzte Zeit leider völlig flach - aber kein Corona (mehrfach getestet). Jetzt geht es endlich wieder bergauf und heute saß ich das erste Mal wieder am Mikroskop. Ich hatte gleich beim Erhalt des Pakets kurz vormikroskopiert und war mehr als überrascht, was ich im Mikroskop gesehen habe. Ich muss dazu sagen, dass ich Gyromitra ambigua ja noch nie in der Hand hatte und eben nur aus der Literatur kenne.
Dank der Zusendung habe ich einiges lernen können. Doch erstmal zur Bestimmung...:
1.) Gyromitra an Pappel - das ist im Mikroskop eine ganz typische Gyromitra infula - also die klassische Bischofsmütze. Insofern war der erste Blick etwas enttäuschend.
2.) Ingo hatte mir aber eine zweite Gyromitra mitgeschicktl. Und zwar eine "normale" Bischofsmütze von Kiefernholz. Also habe ich da auch mal eben reingeschaut – und war mehr als überrascht. Die Sporen sind deutlichg rößer, dann unregelmäßiger geformt, die Gelkappen an den Sporenenden sind auch recht unregelmäßig, mal eine runde Kappe, mal sogar etwas eingedellt oder auch abgestutzt, selten auch spitz ausgezogen - das gibt es bei Gyromitra infula so nicht.
Schaut man dann die Paraphysen an, so fällt auf, dass Gyromitra infula wunderschön aufgeblasene, kopfige Paraphysenspitzen zeigt. Die Köpfe sind richtig breit und teils sogar kugelig. Bei gyromitra ambigua sind sie zylindrisch bis etwas verdickt, teils auch etwas kopfig, aber nie so angeschwollen, keine Kugeln am Stiel.
Jetzt habe ich kein Foto und keine Makrobeschreibung des Fundes - es sei denn, Ingo hat auch Fotos von dieser "normalen" Bischofsmütze gemacht.
Ich zeige einfach mal die Mikrofotos, die ich von den beiden Aufsammlungen gemacht habe... Gyromitra infula war in einem großen Plastikbeutel (und wuchs an Pappel), Gyromitra ambigua war in dem kleinen Plastikbeutel (Infos für Ingo) und wuchs an Kiefer.
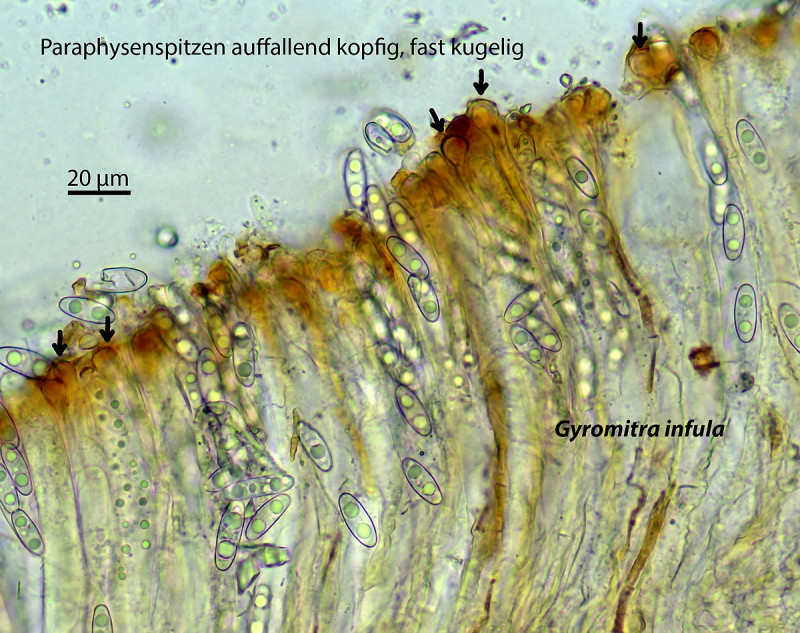
Gyromitra infula – man sieht schön die breiten Paraphysenenden (aufs Bild klicken...). Was man auch schön sieht: die Sporen sind regelmäßig geformt, ellipsoid, teils angedeutet gebogen, aber in sich immer ähnlich; die Sporenenden sind abgerundet, Gelkappen fehlen oder sind noch sehr schwach ausgeprägt.
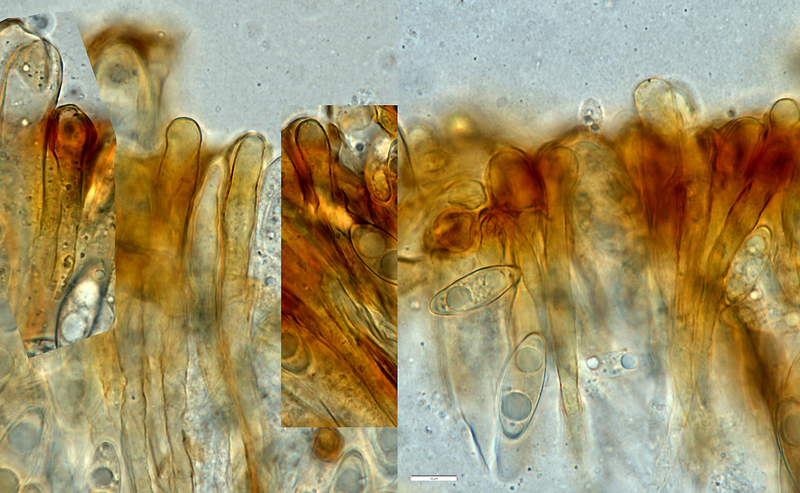
Gyromitra ambigua – Paraphysenspitzen oft nicht oder kaum erweitert, teils auch kopfig, aber nicht so breit und auffällig wie bei Gyromitra infula (Achtung, höhere Vergrößerung als oben - hier ist der Messbalken 10 µm lang)
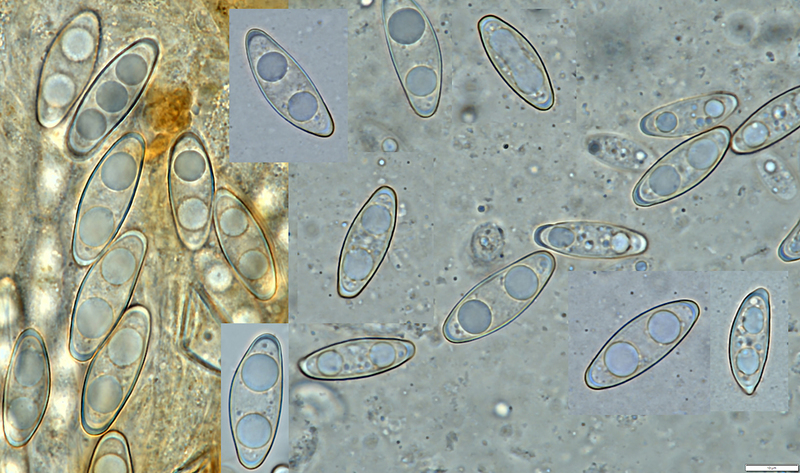
Und hier die Sooren von Gyromitra ambigua - sie sind oft einseitig ausgebeult, manchmal deutlich gebogen, insgesamt "schlampiger", nicht so ellipsoid und auch größer (Messbalken 10 µm).
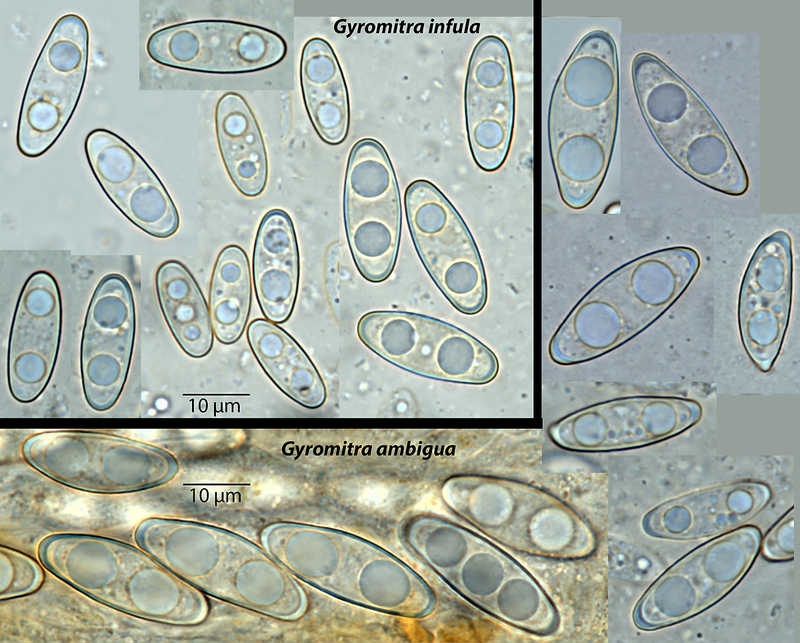
Hier ist es besser zu erkennen – oben links sind Sporen von Gyromitra infula, unten und rechts von Gyromitra ambigua. Man kann die Unterschiede in der Form, der Größe und der Ausprägung der Kappen gut sehen, finde ich.
Dann schaut man sich natürlich auch die Originalbeschreibung von Harmaja an, der Gyromitra ambigua aus Finnland beschrieben hat. Er verwendet genau diese vier Trennmerkmale, um sie von Gyromira infula abzugrenzen:
1.) Paraphysenspitzen
2.) Sporenmaße
3.) Sporenform
4.) Form der Kappen
Und die Ökologie, denn Harmaja beschreibt die Art als typisch für Sandkiefernwälder (!) und er hat sie nur an Kiefer gefunden (!!).
Was habe ich daraus gelernt? Einerseits, wie deutlich die Unterschiede der Mikromerkmale sind - die zwei Arten sind wirklich leicht zu trennen. Andererseits, dass makroskopisch wohl gar nichts geht, was das Erkennen im Gelände angeht. Gut, jetzt habe ich kein Foto der Aufsammlung und habe sie nur getrocknet gesehen, aber die Bischofsmütze an Pappel wäre mir seltsam vorgekommen, dabei ist das eine echte Bischofsmütze. Aber das legt eben nahe, dass man hier die beiden Lorcheln wohl wirklich nicht makroskopisch hinbekommt. Ich würde nämlich nicht ausschließen, dass auch die echte Gyromitra infula an Kiefer in Sandkiefernwäldern wachsen kann.
Nichtsdestotrotz sollte man wohl insbesondere Bischofsmützen von Kiefernholz in Sandkiefernwäldern allesamt nochmal nachbestimmen, indem man sie mikroskopiert. Und die Verbreitungskarten der Bischofsmütze sollten m.E. kritisch hinterfragt werden. Ich würde nur mikroskopierten Aufsammlungen trauen. Denn warum sollte Gyromitra ambigua nur an Kiefer wachsen? Falls dem so ist, wäre das eine sehr wichtige Erkenntnis. Nur muss man dafür erstmal zug Kollektionen prüfen. Spannende Sache!
Ich kann aber mit Überzeugung sagen: Gyromitra ambigua wächst in den Wäldern von Ingo – und die Bischofsmütze auch.
Liebe Grüße,
Christoph



 (Scherz beiseite... den Namen gibt es meine Wissens nicht). Jedenfalls ist "Agrocybe praecox" eine Aggregat aus vier Arten - wurde über Kreuzungstests schon vor langem festgestellt, nur bestimmen kann man die noch nicht. Ist nur für den Hinterkopf gedacht, dass man Agrocybe praecox s.l. vielleicht mal nachbestimmen kann, wenn sich jemand der Gruppe erbarmt und vielleicht doch Merkmale findet...
(Scherz beiseite... den Namen gibt es meine Wissens nicht). Jedenfalls ist "Agrocybe praecox" eine Aggregat aus vier Arten - wurde über Kreuzungstests schon vor langem festgestellt, nur bestimmen kann man die noch nicht. Ist nur für den Hinterkopf gedacht, dass man Agrocybe praecox s.l. vielleicht mal nachbestimmen kann, wenn sich jemand der Gruppe erbarmt und vielleicht doch Merkmale findet...