Servus beinand,
vom Heuschnupfen geplagte kennen es (so auch ich) - die Hasel- und Erlenpollen fliegen, d.h. sie blühen. Im Moment sieht man die männlichen Kätzchen hängen und ihre Pollenkörner ausstäuben. Und genau auf dieses Substrat sind Becherlinge als Nahrungsquelle angewiesen. Sie bilden genau zur Blütezeit (teils schon etwas vorher beginnend) an den vorjährigen, am und im Boden liegenden Kätzchen ihre Fruchtkörper. Die Sporen können so bereits am Baum oder Strauch die blühenden Kätzchen befallen und dort kommensalisch wachsen. Vermutlich können auch frisch gefallene, am Boden liegende Kätzchen so besiedelt werden. Jedenfalls sind sie dann zuerst da und können so wohl besser die Konkurrenz abwehren.
Sucht man auf allen Vieren im zeitigen Frühjahr, wird man eigentlich meist fündig. Einen solchen Fund möchte ich hier gerne vorstellen: Ciboria amentacea.
Ciboria amentacea kommt nur an Betulaceae vor und hier genau genommen nur an Hasel- und Erlenkätzchen. Sehr nah verwandt ist Ciboria caucus, die nur an Weiden- und Pappelkätzchen wächst. An Corylus kommt mit Ciboria coryli noch eine Art vor, die ich bisher vergeblich suche.
Doch erstmal zu Ciboria amentacea - wie sieht sie aus? Sehr hübsch, finde ich, vor allem der weiße, gezähnelte Becherrand:

An einer Böschung direkt am Beurerbach (in meiner Nähe, ein Zufluss zur Windach) unter einer großen Schwarzerle fand ich erstmal einen Becher - mit weißem Rand

Vorsichtig etwas freigelegt und schon sieht man den Stiel. Doch das Substrat?

Jetzt sieht man schon etwas Schwarzes erscheinen...

Und tada... das alte, vorjährige Erlenkätzchen ist zu sehen. Schon etwas mitgenommen, aber erkennbar. Man beachte wieder den schönen, weißen Rand (wie Zucker an einem Glasrand, wenn man manche Getränke schlürft...)

Und erst während des Fotografierens entdeckte ich dann zwei (bzw. drei - da ist noch ein Baby) weitere Becherchen - aller guten Dinge sind drei(einhalb).

Süß, die kleinen. Der "große" maß 4 mm im Durchmesser. Sie können auch mal nen Zentimeter erreichen.
Schauen wir uns die Kerlchen mal etwas näher an...
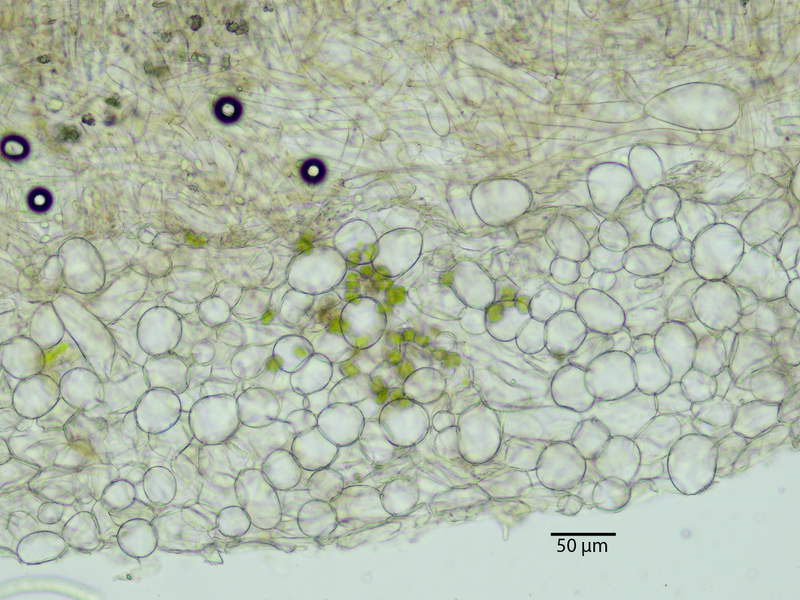
Das ist ein Schnitt durch die Becherunterseite - schöne kugelige Zellen, alles sehr fluffig - das ist das sog. Excipulum. Die kugeligen bis ellipsoiden Zellen drücken teils auch etwas gegeneinander, wodurch sie dann auch ab und zu etwas eckig erscheinen können.
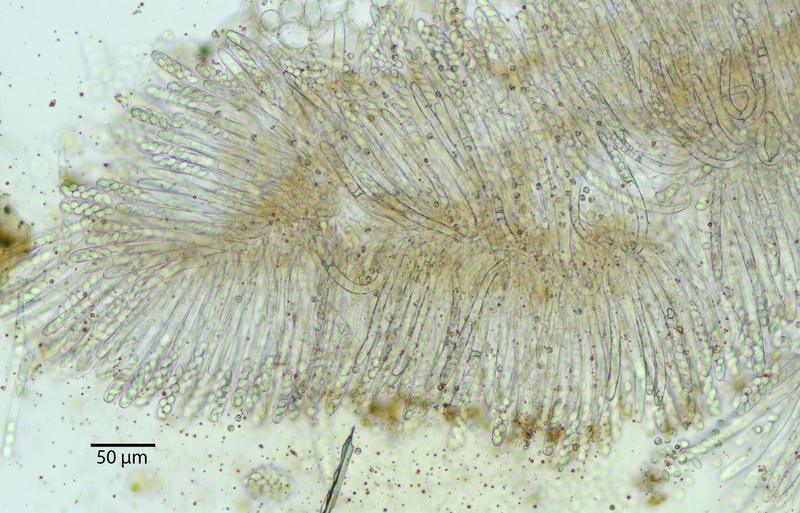
Und hier ein zugegebenermaßen gequetschter Blick auf die Fruchtschicht – deshalb schauen die Asci hier wie bei einem Scheitel in beide Richtungen. Es war ein Schnitt, aber er lag suboptimal. Was man aber schön sieht: das Subhymenium ist etwas bräunlich gefärbt. Die beiden Mikrofotos sind etwas geschummelt, denn die stammen von einem Fund an Haselkätzchen, den ich zwei tage vorher im selben Gebiet gemacht hatte. Deshalb hatte ich das bei dem neuen Fund an Erle nicht mehr so fotografiert.
Zurück zum Erlenfund... schauen wir uns die Asci genauer an:
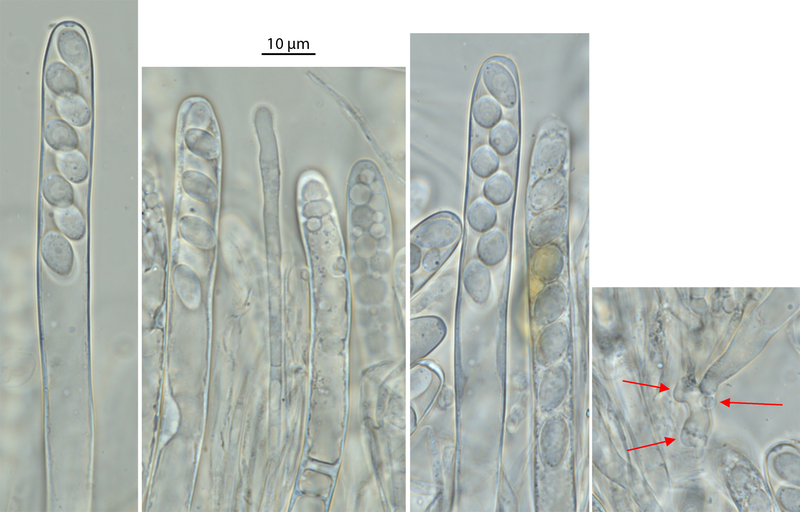
Man kann die Tafel auch groß anschauen (einfach draufklicken). Rechts sieht man Haken, die ja eigentlich auch nur Schnallen sind. Sie werden hier an der Ascusbasis (rechter Pfeil und oberer linker Pfeil) gebildet.Man sieht aber auch schön, dass die Hyphe, aus der die beiden Asci hervorgehen, die sog. ascogene Hyphe, auch Haken besitzt. Das heißt, auch an den Zellen weiter unten, wenn man den Zellfaden weiter beobachtet, findet man deutlich ausgeprägte Haken.
Links sieht man einen Ascus mit acht Sporen - oben erkennt man einen kleinen Ring, sehr seitlich betrachtet. Dieser Ring ist dehnbar. Werden später die Sporen durch Aufbau von Druck im Ascus nach oben gedrückt, dann dehnen diese den Ring an der oberen Pore. Der Ring schnalzt zurück, wenn der breiteste Punkt der Spore durch ist und schießt so die Sporen weit aus dem Schlauch heraus. Oft sind solch dehnbaren Substanzen aus Amylose oder amyloseähnlichen Molekülen aufgebaut bzw. enthalten diese. Das sehen wir dann gleich, wenn ich mit Lugol anfärbe.
Das zweite Bild von links zeigt eine Paraphyse zwischen den breiten Asci. Die ascogenen Hyphen, die in den Asci enden, sind zweikernig. Sie sind das Ergebnis von der Verschmelzung zweier Zellen von zwei passenden, sich "gern habenden" Ciboria-Individuen. Die Paraphysen sind aber nur einkernig. Das heißt, beide Individuen bilden gemeinsam einen Fruchtkörper, aber nur an wenigen Stellen verschmelzen sie auch zellulär, um dann ascogene Hyphen zu bilden, die Meiose auszuführen, also neu zu mischen - und so sexuelle Sporen zu bilden. Wenn der Fruchtkörper später vergammelt, dann sind die beiden Individuen wieder getrennt. Becherlinge sind Gemeinschaftsproduktionen. Finde ich spannend.
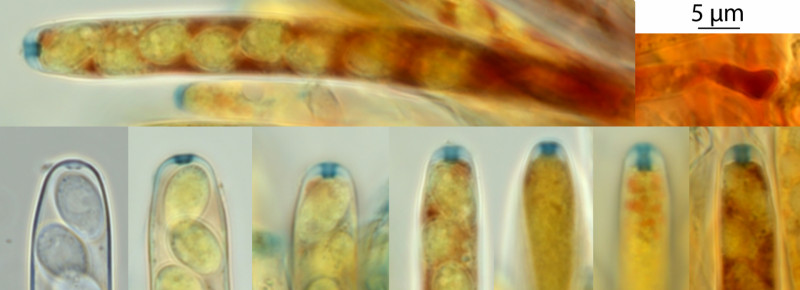
Hier habe ich (bis auf unten links) mit Lugol (Iod mit Kaliumiodid) gefärbt. Alle anderen Fotos sind in Wasser am lebenden Material entstanden. Färben oder anderweitiges Behandeln mit Laugen oder Säuren tötet ab, zerstört Strukturen und verändert die Maße. Daher mikroskopiere ich so viel wie möglich in Wasser und lebendig (auch bei Basidiomycota). Hier wollte ich aber explizit den Apikalapparat mit dem Stärkering anfärben. Auf dem zweiten Bild unten links sieht man nur ganz oben den Ring. Der recht komplexe Apparat ist fast verschwunden und nur noch dieser massive "Gummring" vorhanden. Dieser Ascus ist sehr reif. Er färbt sich auch kaum noch rot (rot färbt sich Amylopektin). Der Reservestoff wurde weitgehend verbraucht, die Sporen sind gewachsen und der Ascus ist zum Abschuss bereit.
Drittes Bild von links, unten: der Ring ist tiefer reichend, oben und unten breiter als in der Mitte und es zeigen sich Feinstrukturen wie eine ca. 0,2 µm dünne, feine, blaue Linie. Der Feinbau des Ascusapikalapparats wurde auch zur Systematik, also der Verwandtschaftsanalyse verwendet (jetzt macht man das meist genetisch). Ich habe mal versucht, so viel wie möglich rauszukitzeln.
Oben habe ich noch einen jungen Ascus quer gelegt, um das Amylopektin (tief rot) zu zeigen. Und oben rechts eine Ascusbasis (auch junger Ascus).
Auch die Sporen sind spannend:
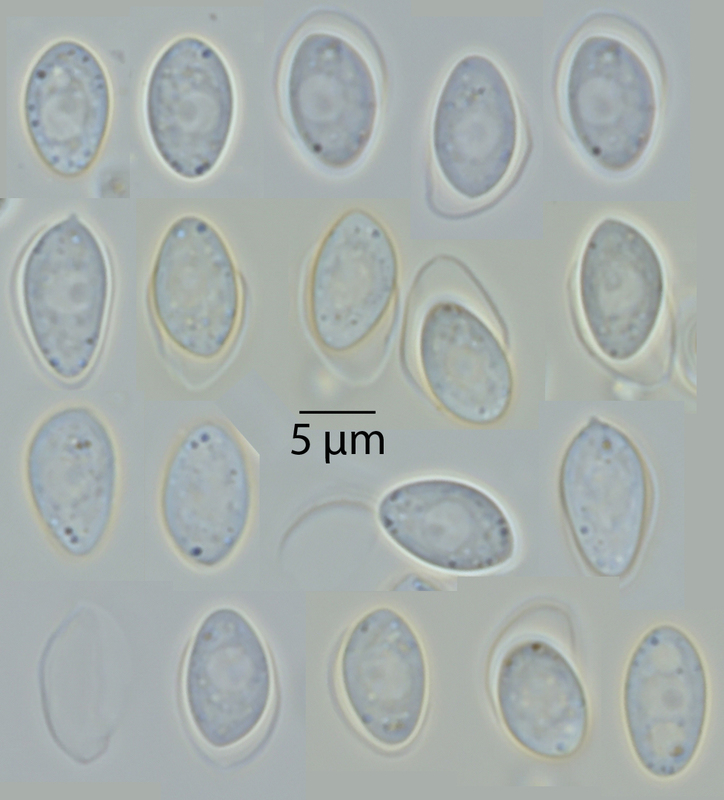
Was ist das? Um die meisten Sporen ist eine farblose Struktur... unten rechts nicht, sonst meist schon. Und unten links ist das Farblose etwas allein. In der Mitte hat es sich fast ganz abgelöst und hängt noch an einem Punkt fest. Nun, die Ciboria-Sporen sind kalyptrat – sie verlieren ihre äußere Sporenwandschicht. Im Ascus sind sie alle noch intakt, nach dem Ausschleudern nicht mehr. Vielleicht passiert das durch das Ausschleudern (Reibnung am Ring), vielleicht auch später in Wasser. Das gibt es auch bei anderen Pilzen, zum Beispiel manchen Häublingen und Fälblingen.
Was mich aber wundert - es steht selten in der Literatur. Bei Pilze der Schweiz ist es z. B. weder erwähnt noch gezeichnet. Hans-Otto Baral hingegen hat das bei seinen Funden, die er bei in vivo veritas vorzeigt, (wie immer bei ihm) sehr schön, korrekt und ausführlich dargestellt.
Was man übrigens auch gut erkennen kann sind die Zellkerne. Man erkennt sie daran, dass sie einen dunkleren Nukleolus enthalten und so ein Bisserl wie ein Spiegelei aussehen. Um sie zu sehen muss man hier gar nicht anfärben. Auch das ist alles in Wasser fotografiert. Bei den meisten Sporne hier sieht man es gut, da der Zellkern sehr groß ist. Unten rechts sind zwei Vakuolen ober- und unterhalb des Kerns – das sieht wie drei Kerne aus. Aber nur der mittlere hat den Nukleolus. Das dunkle an der unteren Vakuole sieht anders aus, nicht so zart-diffus wie der Nukleolus. Das ist ein etwas dunkleres Etwas, was nicht in der Schärfeebene steht.
Wenn man die Sporen als ganzes ansieht, fallen die Kerne deutlich auf.
Ciboria amentacea hat nur einen Kern pro Spore, Ciboria coryli hätte zwei Kerne pro Spore (und größere Sporen).
Ciboria caucus wird übrigens sehr oft als Synonym zu Ciboria amentacea angegeben. Abgesehen vom Substrat unterscheidet sie sich nur ein bisserl an den Sporenmaßen, wenn man die Fruchtkörper anschaut. Kultiviert man sie aber auf Agar, dann erkennt man, dass die Nebenfruchtform der beiden Arten andere Konidien bildet (Form, Größe, Oberfläche). Genetisch lassen sie sich auch trennen. Und ich finde, durchaus auch makroskopisch. Ich kenne Ciboria caucus kräftiger und der Stiel ist gerne sehr kompakt und zudem recht dunkel. Und natürlich das Wachstum an Weidenkätzchen. Den weißen Rand zeigt aber auch Ciboria caucus
Ich zeige mal eien Fund aus Mammendorf aus dem Jahr 2019:




Alte Weidenkätzchen aus dem Vorjahr sind viel puscheliger als Erlenkätchen (oder Haselkätzchen). Funde an Corylus müssen mikroskopiert werden (wegen Ciboria coryli). Ich wüsste nicht, dass die mal an Erle gefunden wurde. Insofern kann man auch ohne Mikroskop zumindest Funde an Erle und an Weide (und Pappel) bestimmen:
An Erle: Ciboria amentaceae
An Weide und Pappel: Ciboria caucua
An Hasel entweder Ciboria amentacea oder Ciboria coryli
Ich kann nur empfehlen, mal selber nach den kleinen Becherchen zu suchen. Ciboria caucus kommt etwas später, wenn die Weiden in voller Blüte stehen.
Liebe Grüße,
Christoph
. Nun ist es aber so, dass es zur Lehrerausbildung gehört, Prüfungsfragen zu formulieren. Lehrer sind sozusagen die Handwerker im Formulieren von Prüfungsfragen.



