Hallo zusammen,
herzlichen Dank für eure zahlreichen Hinweise und den Diskurs. Leider schaffe ich es erst heute zu antworten, da mich die Arbeit in den letzten zwei Tagen stark in Beschlag genommen hat.
Claus: Ich habe nochmals Bilder in Wasser gemacht (Kongorot habe ich zur Zeit nicht zur Verfügung). Ich meine dort die Einschlüsse bzw. "Krümelchen" zu sehen, von welchen du bzw. Oehrling berichtet. Hier die Aufnahmen (und nochmals danke für deine Ermutigungen).
bei 400-fach in H2O

Bei 1000-fach in H2O

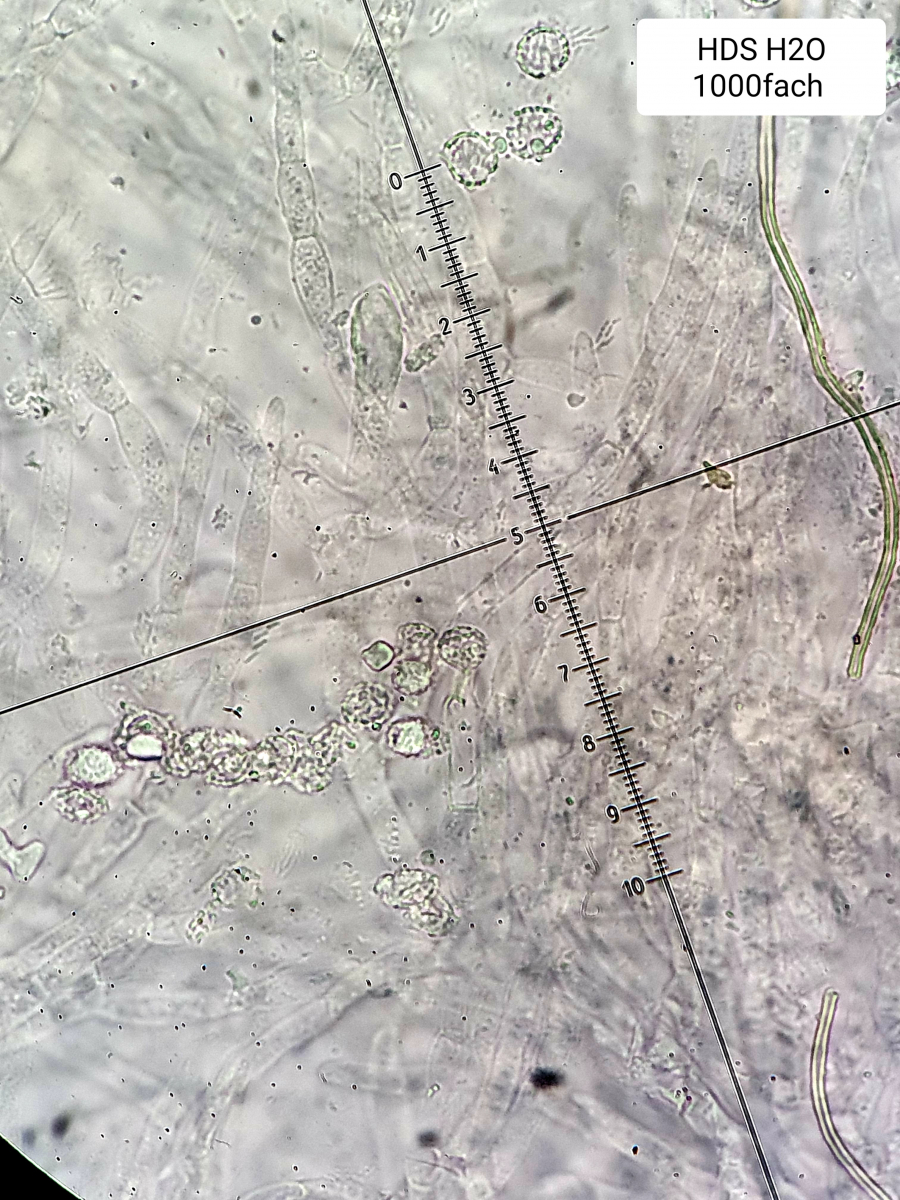
Wenn man etwas mit der Schärfeebene in die Tiefe geht und mit den Blenden spielt, ergibt sich nochmal ein ganz spannendes weiteres Bild der Einschlüsse (sieht nahezu invertiert aus interessanterweise)

@ Oehrling: herzlichen Dank auch dir für deine wieder sehr ausführlichen Hinweise und Ausführungen.
es wird Zeit, dass du lernst, auf welche Merkmale es bei der Griseinae-Bestimmung überhaupt ankommt
Naja, ich glaube ich bin sogar erst noch eine Stufe drunter. Ich merke gerade, dass es nicht reicht loszuschlüsseln, sondern etwas Wissen zu den Unterscheidungsmerkmalen der unterschiedlichen Sektionen wäre ganz hilfreich. Sicher weiß ich, das es Sektionen gibt und für einige sind mir auch einige Merkmale bekannt (z.B. Compactae), aber viele Sektionen kann ich abgesehen vom Sporenpulver so gar nicht auseinanderhalten. Leider ist das Werk von Marxmüller und der Schlüssel von Bresinsky da auch nicht besonders lehrreich, denn im Beschreibungsteil gibt es keine Erläuterungen zu den Sektionen, sondern nur zu den Arten und im Schlüssel findet sich dazu (verständlicherweise) auch nichts, da heißt es
Schlüssel IIIh (Griseinae)
1a Sporenpulver weiß (Ia-b) I
1b Sporenpulver gefärbt
und dann gehts weiter mit Detailfragen. Deswegen habe ich auch nicht nach Haaren geschaut/gefragt, da im Schlüssel erst die Sporenpulverfarbe abgefragt wird (die mich via Ocker IIIa in der Tat auch nicht zu grisea führt) und dann im wesentlichen als nächstes die Pileozystiden von Interesse sind. Dazu hatte ich dann in SV mikroskopiert (pink-Färbung mit schwarzen Pileozystiden), dieses Präparat habe ich dann nochmal in Wasser eingelegt, was die anderen Bilder mit den schönen Endhyphenzellen (Haare???) ergeben hat.
Und bei Aufnahmen, die mit Karbolfuchsin angefärbte uninkrustierte Dermatozystiden-Keulen zeigen, denke ich mir (ich bin ein Freund klarer Worte): schade um das Karbolfuchsin
Ich habe hier kein Karbolfuchsin verwendet.
Wenn du jetzt im Schlüssel zu R. medullata gelangst, kann dies eigentlich nur aufgrund der Sporenpulverfarbe, in der du IIIa siehst, erfolgt sein. Warum hast du dann eigentlich mikroskopiert? Mit den Mikrofotos und dem darinsteckenden Aufwand hast du der Sporenpulverfarbe kein weiteres Beweismaterial hinzugefügt, mit dem man R. medullata dingfest machen könnte.
In der Tat hat mich das "Ockersporige" in diese Richtung geführt. Mikroskopiert habe ich, weil der Bestimmungsschlüssel ja nicht folgendermaßen geht: Russula - Ockersporer - 3a = medullata ... sondern zwischen Ockersporer und Medullata im Schlüssel zahlreiche Zwischenschritte liegen. Auch solche die dann eben nach Pileozystiden fragen. Mir fehlt die Erfahrung oder das Wissen um von IIIa auf eine bestimmte Art zu schlussfolgern.
außerdem vermisst man in den Fotos der Huthaut die für den Nachweis von R. medullata ganz wichtigen Tönnchenketten
Dieses Merkmal wird bei Marxmüller im Zusammenhang mit der entsprechenden Art gar nicht beschrieben, zumindest habe ich weder den Begriff gefunden (bei drei anderen Arten wird er in MXM genutzt, z.B. bei R.amoena), noch ähnliche Umschreibungen für solche Strukturmerkmale. Einzig auf den Mikrozeichnungen könnte man das bei MXM erahnen. Danke für den Hinweis, vermutlich finden sich solche Beschreibungen im jetzt schon oft und von mehreren zitierten Sarnari? dann auch für medullata?
Im Idealfall sollte man daher einen Täubling makroskopisch erraten können, und das Mikroskop nur dazu benutzen, den anfänglichen Verdacht zu beweisen/zu widerlegen. Klar geht das nur mit viel Erfahrung.
Genau die fehlt ja ...
Aber man sollte, noch ehe man das Mikroskop einschaltet, eine ungefähre Ahnung davon haben, was man da gleich zu sehen bekommt. Zumindest auf was man da jetzt gleich, wenn das Bild erscheint zu achten hat bzw. nach was genau man suchen soll.
Ich arbeite dran ...
das geht nur mit guter, wirklich sehr guter Literatur - oder mit dem Wissen, das man sich auf einem Täublingsmikroskopierkurs erworben hat.
Ich denke so ein Kurs wäre wirklich mal spannend und würde einen schnell weiterbringen. (Vielleicht nehme ich noch dein Angebot an und mache den dann gleich in einem Rutsch mit im nördlichen Baden-Würtemberg  .
.
das, was sich auf deinen Mikrofotos erkennen lässt, führt eher von R. medullata weg und hin zu R. grisea, was Claus ja auch schon bemerkt hat. Für R. medullata sind viel zu viel Verbindungslinien zwischen den Sporenwarzen
Ich denke, das ist in der Tat ein wichtiger Hinweis, denn die gratigen Verbindungen waren schon "relativ oft" zu erkennen. Bin da einfach auch noch etwas unsicher, was "selten" oder "deutlich" bedeutet.
Stattdessen sieht man (mit etwas Spekulation, da nicht in Kongorot) lange, spitz auslaufende Endglieder, die R. medullata nun mal nicht hat
Ich finde, die Endglieder kann man doch deutlich erkennen in den verschiedenen Wasseraufnahmen (nach SV und auch in den aktuellen nur in Wasser). Weil die nicht passen hatte ich ja auch selbst bereits an medullata gezweifelt:
Endzellen aber eher spitz als stumpf abgerundet, wie bei medullata beschrieben
Eine Pappel war dort in der Tat weit und breit nicht, ein wichtiger Hinweis! (habe aber auch schon gelesen, dass auch Buche in seltenen Fällen ein Partner sein kann, wenn auch nicht typisch)
Abschließend wollte ich darauf hinweisen: falls das Posting dir nichts bringt oder dich in irgendeiner Form verärgert, ignoriere es einfach.
Ach quatsch, ich bin da wenig empfindlich. Ich denke ich kann von euch eine Ganze Menge lernen, dass ist ja auch das Ziel. In deinem Beitrag und denen der anderen finde ich viele bedenkenswerte und wichtige Hinweise, die mir sicher in Zukunft helfen, dass Ganze besser zu machen. Zumindest in Teilen. Ohne bessere Kenntnisse der Sektionen, werde ich wohl weiter etwas unsicher durch den Bestimmungsschlüssel irren. Das Schlüsseln ist denke ich auch nur mit viel Übung genau zielführend, wie man sieht verläuft man sich ja schnell mal. Suche ich im Schlüssel von R.grisea aus rückwärts bin ich in der Tat infolge des "ockersporigen" schon sehr früh falsch abgebogen im Schlüssel. Aber ganz ehrlich, ich bleibe auch nach Kontrolle bei IIIa (habe den Romagnesi mit Original-Farbtafel und auch die Farbtafel von MXM, ich lande da bei Ocker, wenn auch hell, also a)
Christoph
auch dir ganz vielen Dank für die zahlreichen Hinweise und Ermutigungen.
Makroskopisch geht da aber so gut wie nichts in der Guppe
Kann ich den makroskopisch zumindest in der Gruppe landen?
erst die Merkmale sauber erheben, dann schlüsseln
Werde versuchen noch besser zu verstehen, worauf es da ankommt.
wofür steht s. str.
Ihr drei habt mir sehr geholfen, ich denke man kann hier klar von R.grisea ausgehen, da im Grunde alles passt. Spannend finde ich auch, das sowohl bei MXM als auch in anderen Quellen die rosagefärbten Frassstellen aufgeführt sind. Die sieht man ja bei meinem Pilz in der Tat sehr deutlich.
meine Pilzfreundin und Russula-interessierte Heidrun meint auch immer, dass bei Täublingen das wichtigste erstmal die Ökologie, Sporenpulverfarbe, Geruch und Geschmack als wichtigste Bestimmungsgrundlagen
die Ökologie muss ich noch bewusster beachten bzw. nachhalten. Da bin ich manchmal vor lauter Pilz etwas unaufmerksam. Im Grunde kenne ich die Standorte, wo ich diese Exemplare finde ausgezeichnet. Kalkhaltiger Auwald mit Buchen und Eschen.
kann ich mir bei den Griseinae heraussuchen ob ich R. inonochlora oder R. prazurea habe
Das ist doch aber auch nicht schön  ... ein wenig Abwechslung machts doch interessant.
... ein wenig Abwechslung machts doch interessant.
Liebe Grüße und nochmals herzlichen Dank euch allen ...
Sebastian


