Hallo zusammen,
habe einen völlig unklaren Fall, der mir schon im "Feld" seltsam vorkam und bei dem auch nach Mikroskopie selbst die Gattung für mich nicht klarer geworden ist. Vielleicht könnt ihr mir mal auf die Sprünge helfen. Hier erstmal die Fakten, bevor ich euch meine bisherigen Bestimmungsversuche schildere:
Also, kleiner Pilz (Hut ca. 1cm) gesellig wachsend auf Sand in ehemaligem Sandabbaugebiet.
Bäume in der Nähe: Weide, Pappel, Birke, Hartriegel ... Erle ist da eigentlich keine in der Nähe.

Lamellen auffällig weit auseinanderstehend, ausgebuchtet angewachsen und mit Zahm herablaufend:

Lamellenschneiden weiß gezähnelt (Cheilozystiden):

Geruch konnte ich nicht feststellen (da raoch eher der anhängige Sand)
MIKROSKOPIE
Sporen in KOH3% mandelförmig mit suprahiliarer Depression, kräftiges Ornament, heute noch aus Abwurf gemessen:
9,3-11,0 µm (av. 10,0 µm, SD 0,5 µm) x 5,2-6,5 µm (av. 5,7 µm, SD 0,3 µm); Q = 1,6-1,9 (av. 1,7, SD 0,1)(n = 10)

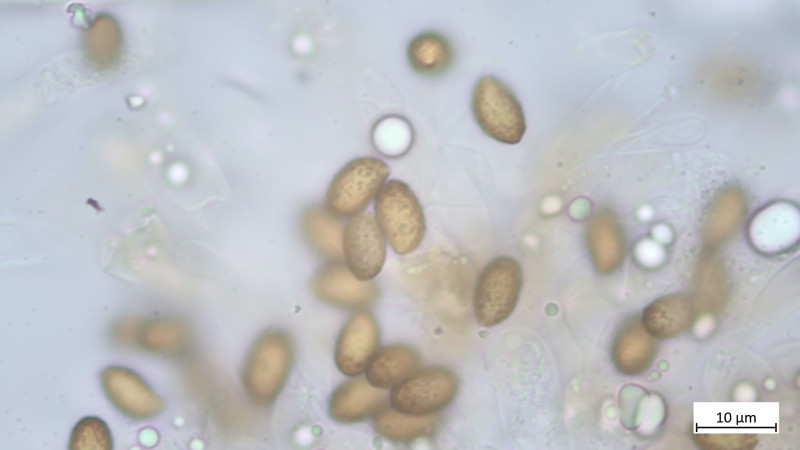
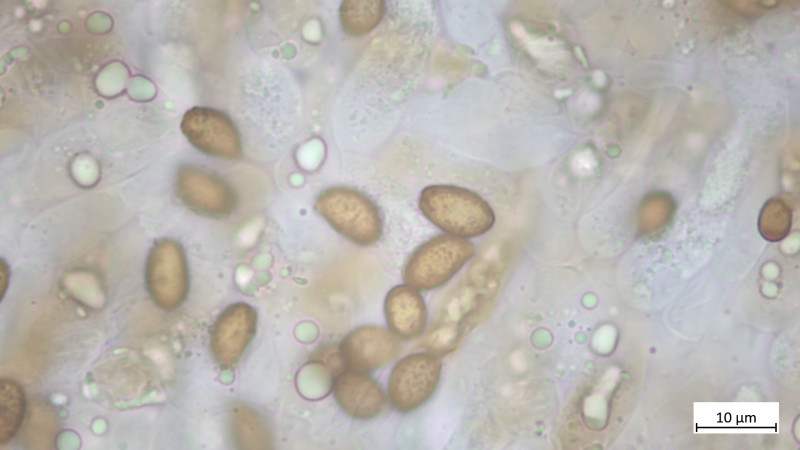
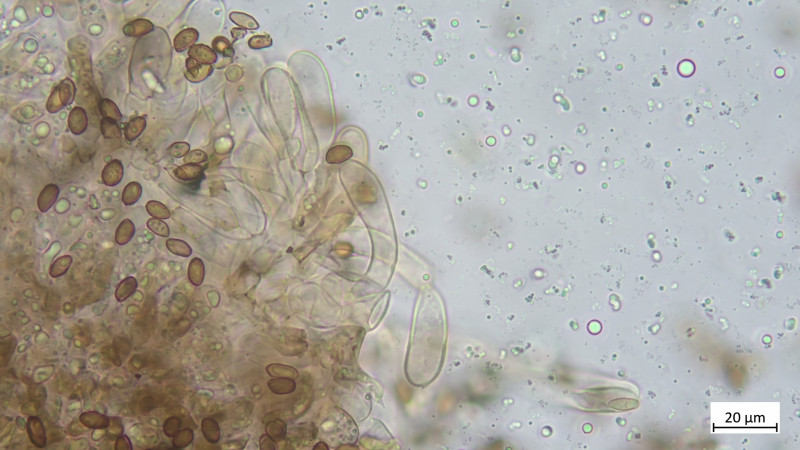
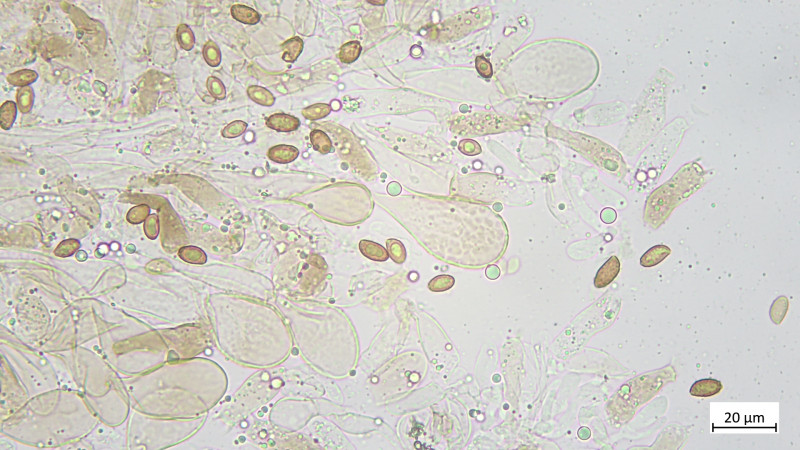
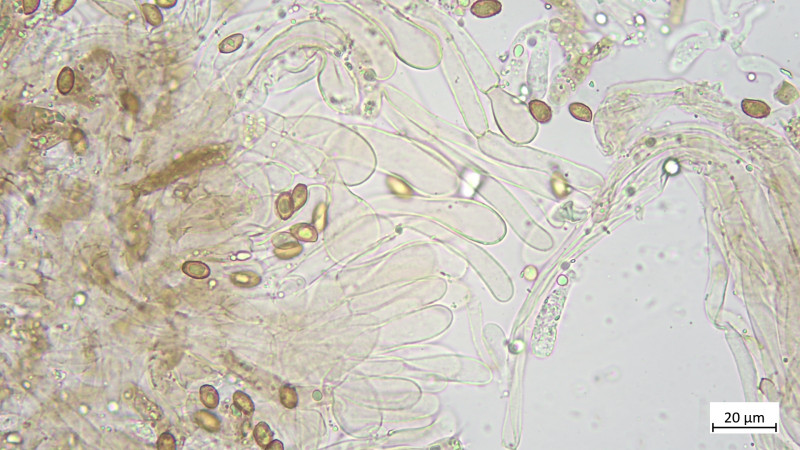
Das Teil hat keine Pleurozystiden, dafür besonders auffällige und zahlreiche Cheilozystiden mit ! Inkrustierungen ! (Habe ich so noch nie gesehen und wüsste auch nicht, welche Gattungen / Arten das können:

Hier vergrößert: CAVE: Maßstab im folgenden Bild stimmt nicht (habe vergessen umzustellen, eher 10 als 20µm)
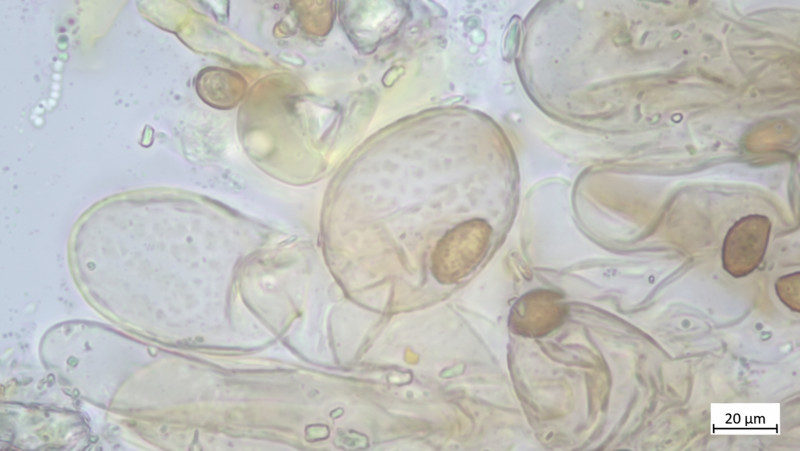
Hier sehr gut Inkrustination auch in der Zystidenwand zu sehen (Längliche, keulige Zystide etwa Mitte des Bildes), hier stimmt auch der Maßstab wieder:
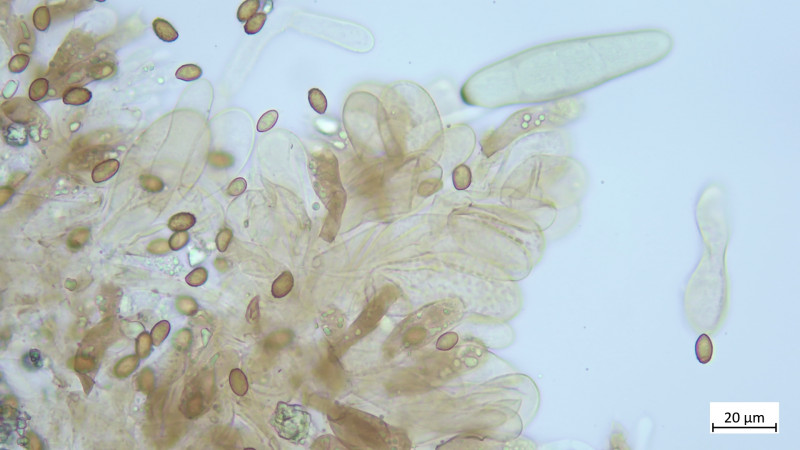
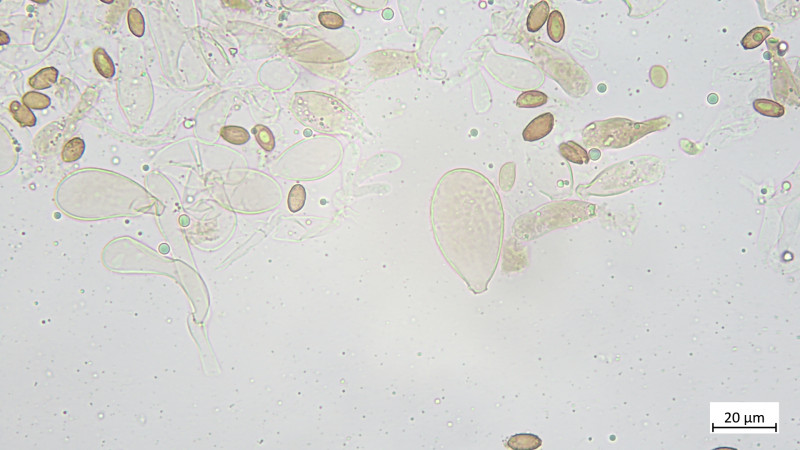
Zystiden keulig bis blasig, mehrteilig bzw. septiert:
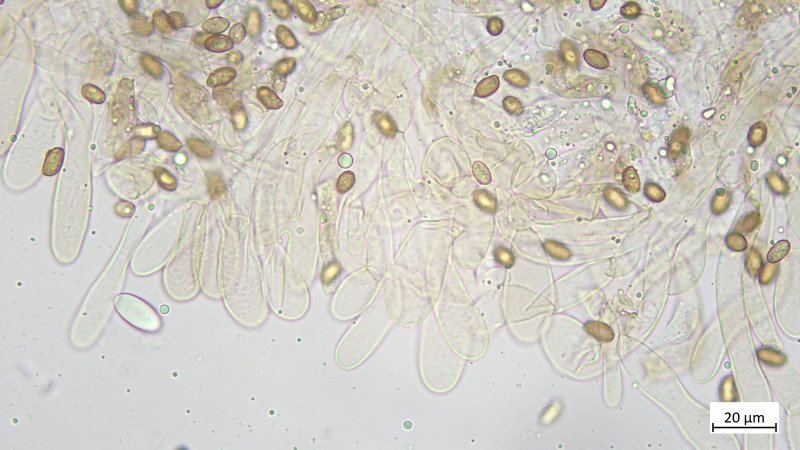
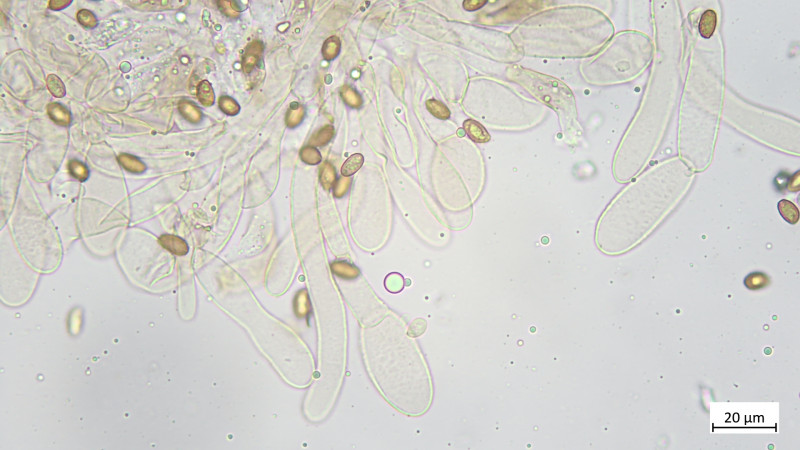
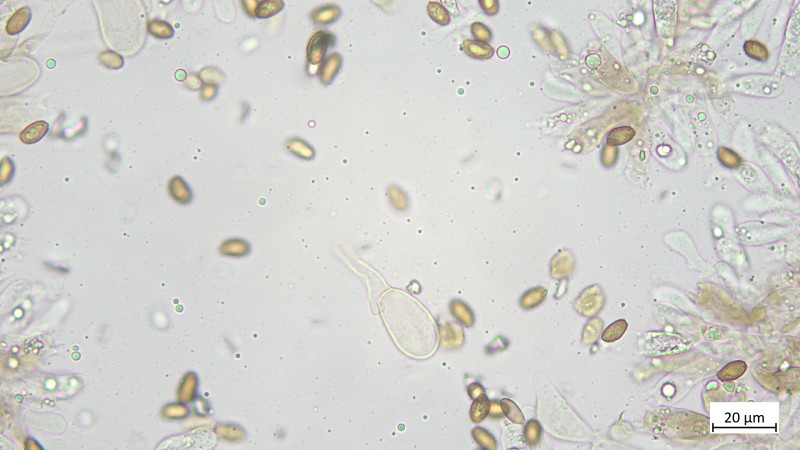
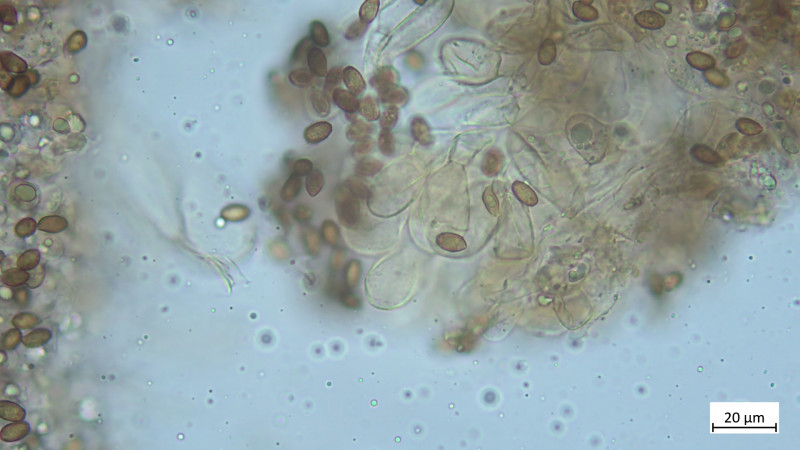
Hutdeckschicht aus liegenden Hyphen (cutisartig). Teils schlanke teils stark aufgeblassene Hyphen, alles stark inkrustiert, keine Zystiden oder irgendwelche Endzellen:
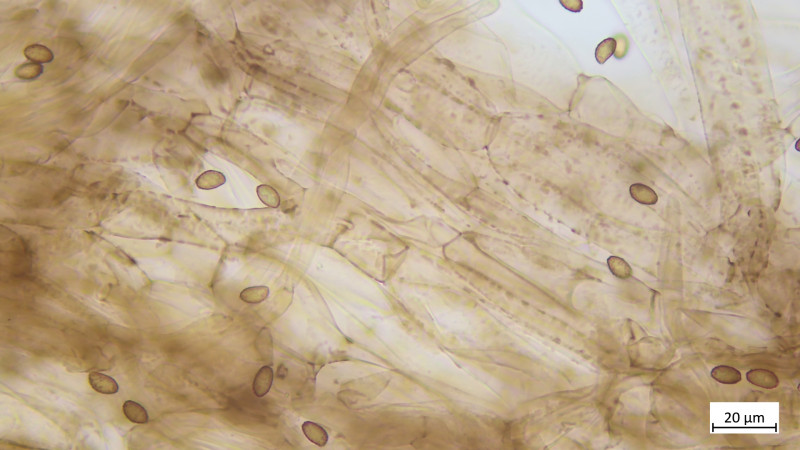
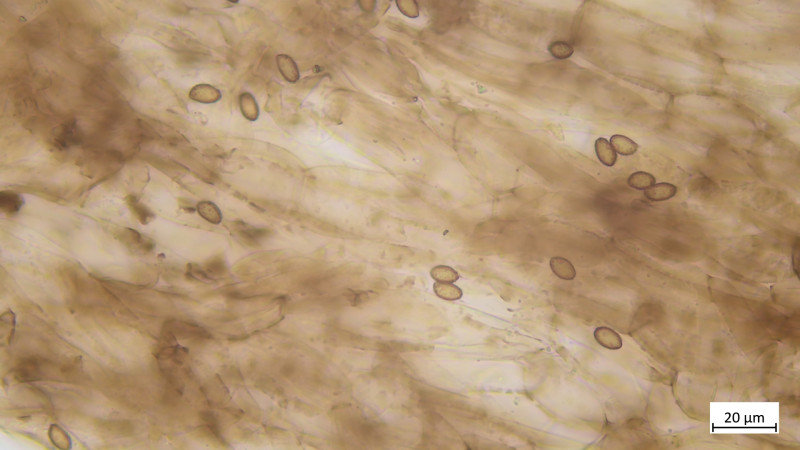
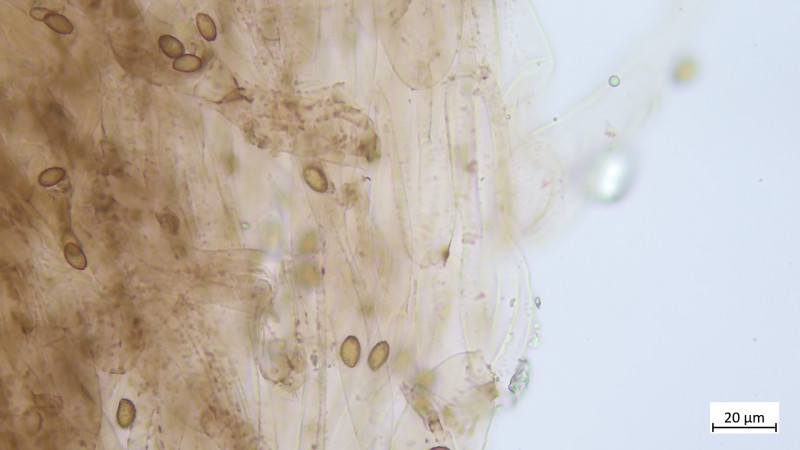
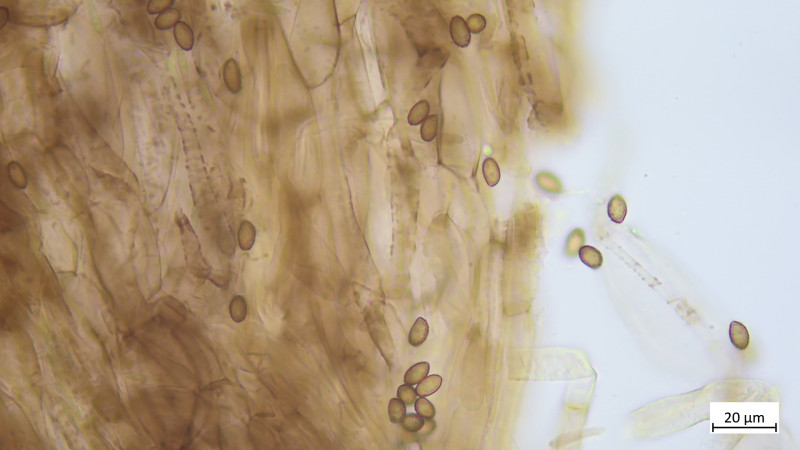
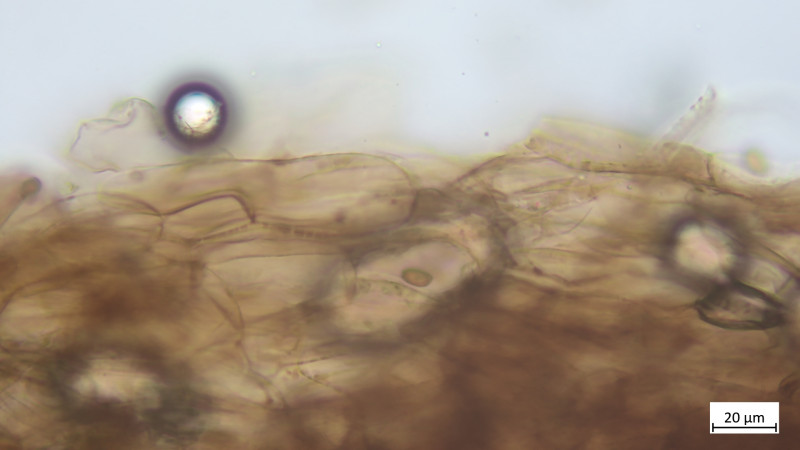
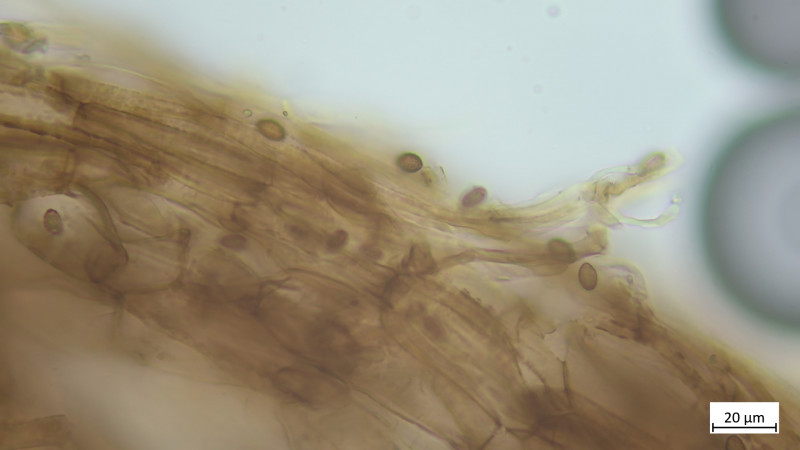
Keine Kaulozystiden, Stielhyphen ebenfalls stark inkrustiert:
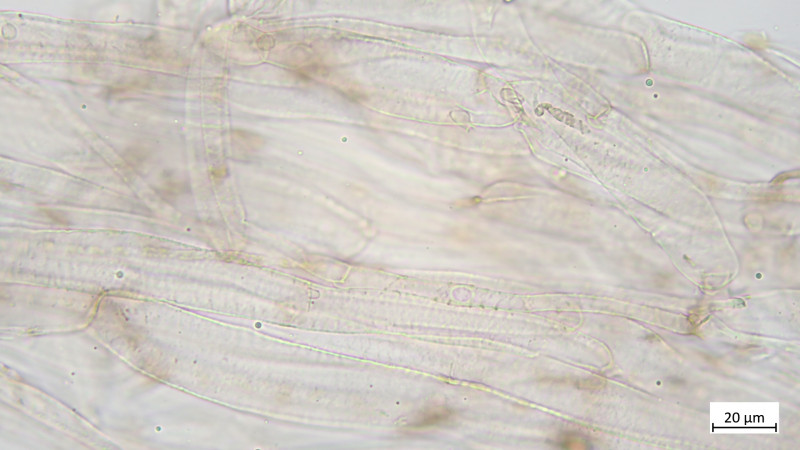
Also, ich würde Telamonie irgendwie ausschließen wollen, wegen dieser Cheilozystiden? Aber was kann das sonst sein? Naucoria würde ich wegen der HDS ausschlüsseln und Galerina passt auch irgendwie gar nicht.
Stehe komplett auf dem Schlauch. Habt ihr eine zündende IDEE?
LG Sebastian


