Servus zusammen,
in dieser pilzärmeren Zeit kommt ja mancher Pilzfreund auf eigenartige Ideen. Einige kratzen an Ästchen, scharren im Laub oder wühlen in der S***. Eine nicht minder verrückte Idee: Moosbecher suchen. Ja klar, Moos gibt es überall, ist doch toll!
Aber genau das ist der Sächsämter an der Discounterkasse. Überall lauert die Versuchung! Und Moose sind zwar häufig, aber die stecknadelkopfkleinen Edelsteinchen sind selten genug um immer wieder ein Lotteriegefühl zu verursachen- im nächsten Mooskissen sitzt bestimmt einer! Mist, wieder ne Niete. Nach gefühlt einigen abgescannten Fußballfeldern an Moosstoppeln, kurz vor der Erkenntnis, dass es vermutlich schönere Tätigkeiten gibt um sich Augen und Rücken zu ruinieren, dann doch ein Treffer. Grandios! Es gibt sie wirklich! Welch Glücksgefühl! Eigentlich war es doch gar nicht so schwer... und außerdem sonnenklar dass sie dort wachsen müssen in der kleinen Rinne im Beton! Man denkt, die Nächsten finde ich bestimmt schneller, jetzt wo ich das Habitat kenn... und so folgen die nächsten Fußballfelder an Waschbeton, U Bahnverschalungen, Mülltonnenunterständen...
Und dann, die Beute im Döschen auf dem beschwingten Heimweg stellt man sich vor: die schmeiß ich jetzt unters Mikro, genieß die Sporen und bestimm sie.
Haha. Denn man merkt schnell: ohne Moos nix los. Will heißen: erstmal Moos bestimmen, dann reden wir weiter. Wer nun denkt, ja mei, da schau ich halt mal in einem Moosführer nach...
kein Problem: es gibt da zB das dreibändige Werk "Die Moose Baden Württembergs", Stück ca 1,5Kg. Lebermoose mitgezählt etwas mehr als 1000 Arten.
Dazu kommt noch es wächst oft nicht nur ein Moos am Fundort, das in Frage kommt...und das Befallene ist möglicherweise auch noch das am schwächsten vertretene.
Gut, man will ja beschäftigt sein in dieser sauren Gurkenzeit... (ich habe die Schinken nicht, ein nettes Forenmitglied half mir mit Literatur aus und ich hatte Glück, dass es häufige, gut kenntliche Moose waren) Und so kam schließlich der folgende Beitrag zustande. Gesammelt seit Winterbeginn im Nürnberger (Innen-)Stadtgebiet, bestimmt immer mal wieder.
Einer ging mir durch die Lappen da im Kühlschrank verschimmelt bis ich Zeit hatte ihn anzuschaun. Wäre besser gewesen ihn einfach auf dem Balkon zu lagern, denn austrocknen oder durchfrieren können sie offensichtlich ab. Ich habe eine Kollektion bei Minusgraden und Schneefall entdeckt, mikroskopisch völlig in Ordnung.
Nebenbei bemerkt habe ich leider keine einzige Lamprospora gefunden auf die ich es wegen der hübschen Sporen eigentlich abgesehen hatte, da muss ich euch gleich vorneweg enttäuschen. Auch das gehört zur Lotterie, die meisten Moosbecherarten gehören zu Octospora und haben "Allerwelts" Sporen wie eine beliebige Peziza.
Spannende Sachen kann man trotzdem mit den Teilen anstellen wenn man versucht die Infektionen an den Rhizoiden der Wirtsmoose nachzuweisen. Und ein Bisschen Botanik ist auch mal ganz schick unter dem Vergrößerungsglas.
So, was ist das nun wieder für ein Geschwafel geworden? Zeit für ein paar Bilder oder Heiderzack jetzt halt ich die Bapp.
Der erste Fund: Octospora musci muralis an Grimmia pulvinata. Der Fundort war eine Sandsteinmauer der Nürnberger Kaiserburg. Ich hatte gezielt Areale mit bräunlich verfärbtem (aka hoffentlich geschwächtem) Moos abgesucht aber nichts gefunden. Schließlich fand ich sie auf dem Heimweg in einem wunderbar vitalen, leuchtend grünem Moospolster auf der Oberseite einer Mauer. Zum Glück leuchteten sie wie mit einem Textmarker markiert und waren mit 2-4mm relativ groß.


Daneben lag eine mit Beauveria bassiana verpilzte Wanze. Mir fiel erst auf dem Bild auf, dass sie vermutlich im Todeskampf noch Eier herausgepresst hatte.

Zu Hause gelangen zwar bessere Aufnahmen, aber ich hatte Probleme mit dem Weissabgleich


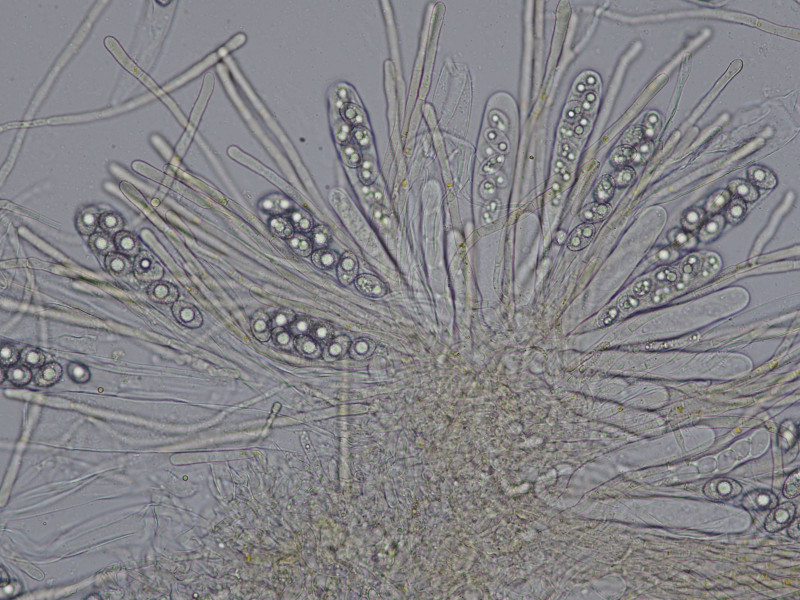
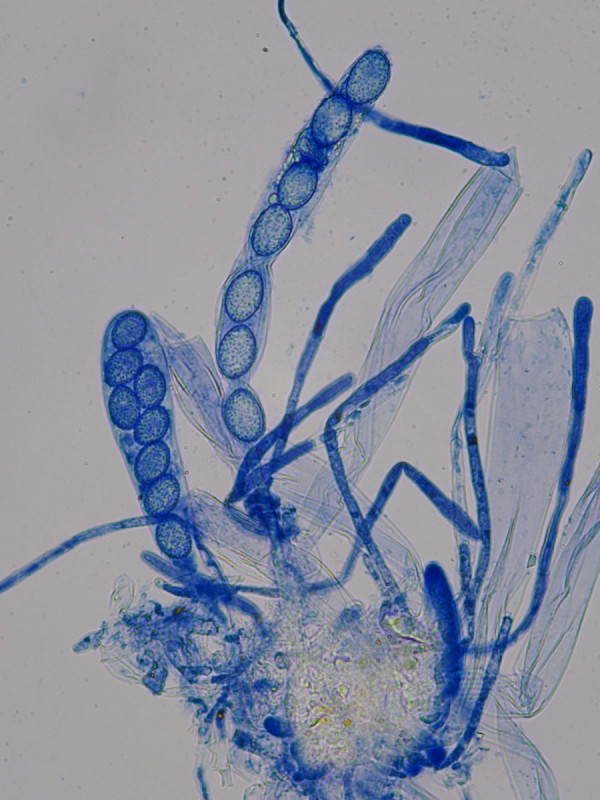
Mikroskopisch charakterisiert durch gebogene, pigmentierte Paraphysenenden und biserate Asci:

Rand"haare"

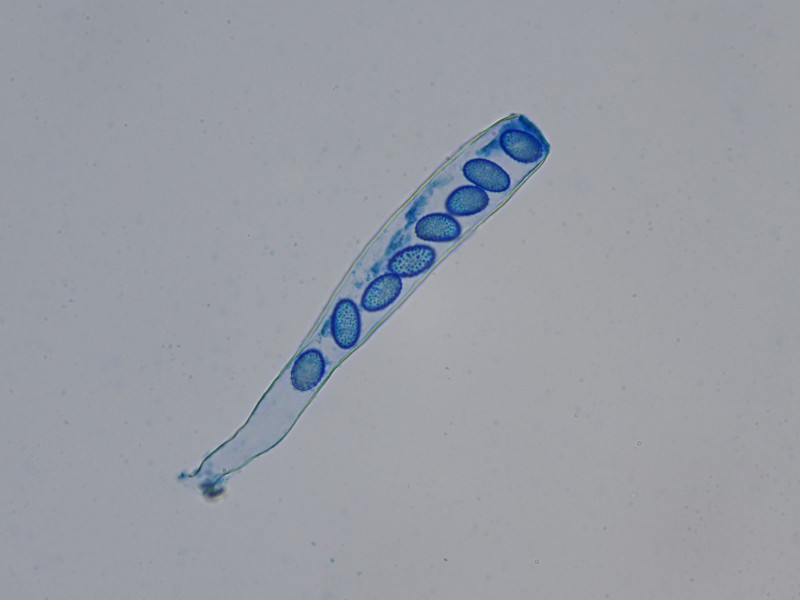
Sporen glatt mit meist zwei großen Öltropfen


(21.7) 23.2 - 26.7 (27.8) × (9.4) 9.9 - 10.5 (10.8) µm Q = 2.2 - 2.6 (2.9) ; N = 22
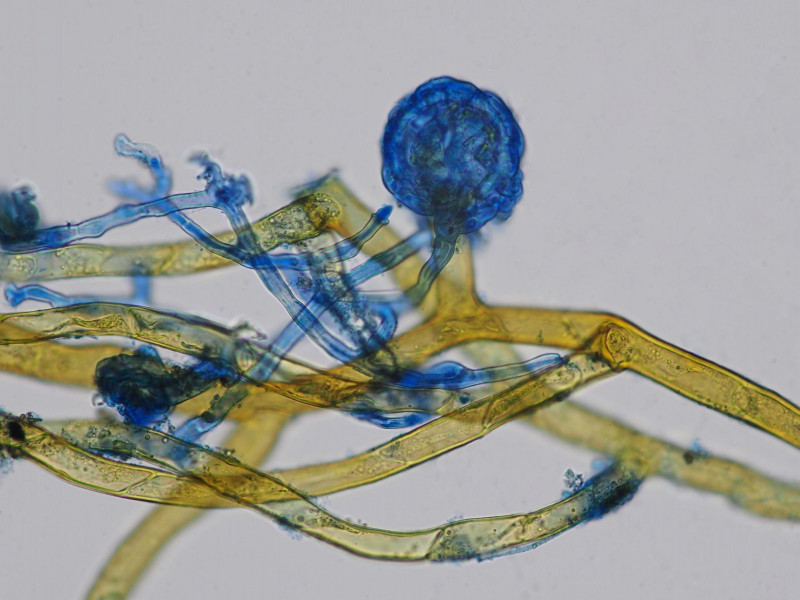
Infektion: gelbbraun die Rhizoide des Mooses; in Baumwollblau/Milchsäure gefärbt die Hyphen welche sich zu einem spezialisierten Haftorgan dem sog. Appressorium ausbilden um in den Wirt eindringen zu können.

Die Präparation verlangt oft mehrere Anläufe mit Vorwaschungen und führt dennoch zu einem exorbitanten Deckglasverbrauch, da die Rhizoiden aufgrund des Sandsteins hier viele Quarzkörnchen mitbringen.
Bonus: dieses (scheinbar?) gliedmaßenlose Tierchen, dafür mit ordenlichen Kneifern wohnte im Moos- vielleicht kennt es ja einer von euch?

Die zweiten Becher fand ich in großer Zahl in einem schattigen Gebüsch auf einem bemoosten Erdhaufen, der nach Bauarbeiten wohl nicht wieder abgetragen worden war.
Es handelt sich um Octospora rustica an Ceratodon purpureus.


Apothecien zwischen Birnmoos (Bryum spec.), dies ist jedoch nicht der Wirt

sondern das geschwächte purpurstielige Hornzahnmoos (Ceratodon purpureus)

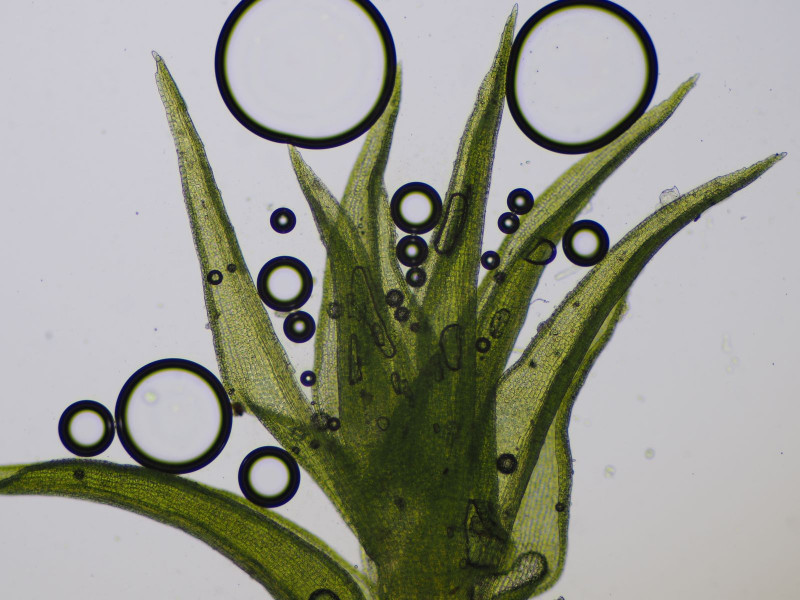



Mikroskopisch unspektakulär, Asci uniserat, Paraphysen ohne sonderlich gefäbte Pigmentgranula oder Vakuolen

Sporen glatt, breitelliptisch, ein großer Öltropfen

(13.2) 14 - 15.1 (15.4) × (10.2) 11 - 11.8 (12.3) µm Q = (1.1) 1.2 - 1.37 (1.4) ; N = 19
hier lässt sich die Binnenstruktur des Appressoriums gut erkennen

Der dritte Fund, den ich vorstellen möchte ist Octospora orthotrichi an Orthotrichum diaphanum. Der Fundort war eine Betonmauer welche einen Kinderhort von einer vierspurigen vielbefahrenen Straße trennt. Ich musste den Kopf frei bekommen und fast schon gedankenlos (Suchtverhalten s.o.) überflog ich im Vorbeigehen die kleinen Moospolster, die sich darauf gebildet hatten. Diese waren wirklich klein, vielleicht bis 1cm im Durchmesser. Es begann zu Schneerieseln. Doch da waren tatsächlich winzige bis 1mm große Becher! und mein Tag war gerettet.

Rechts Birkensame, Links Apothecium (<1mm)
Ein paar Tage später war ich mittlerweile bei Dauerfrost nochmals dort und konnte noch einige weitere FK finden.




Hier hatte ich zunächst das Moos fälschlicherweise als Schistidium spec. bestimmt.



Mit den Sporenmaßen und der Ornamentation landet man dann bei Octospora pseudoampezzana. Passt auf den ersten Blick perfekt. Zum Glück traute ich meinen Moosbestimmungen erstmal nicht, denn ich hatte nur die "Blättchen", aber keine Sporenkapseln untersucht.
Das holte ich bei meinem zweiten Besuch nach und siehe da, die Kapseln passten überhaupt nicht und ich konnte das Moos schliesslich als Orthotrichum cf diaphanum bestimmen.

Mikroskopisch war er der schönste der Drei, mit feinwarzig ornamentierten Sporen uni- und biserat!


die Sporen sind bei dieser Art typischerweise in der Seitansicht "brotförmig", sprich sie haben eine gerade und eine gekrümmte Seite.
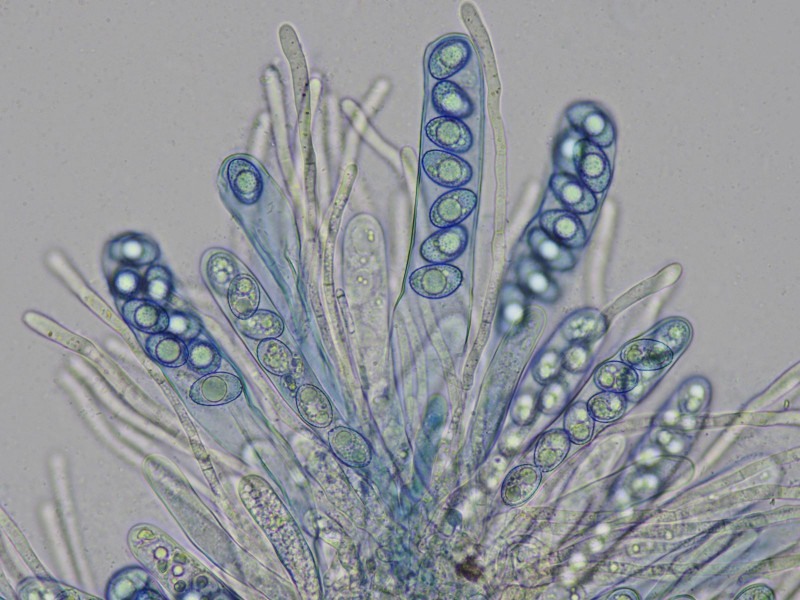
Färbung mit tpb um mögliche Schrumpfungsartefakte durch bwb auszuschließen
Rand"haare"

Übersichtsbild mit Moos und parasitierendem Fruchtkörper, Appressorium rechts unten

Ausschnittsvergrößerung mit Appressorium

fragliche gallenartige Infektion/ Hyphenknoten links

Sphärisches Infektionsorgan/Appressorium
So das wars erstmal, mir hat der Ausflug in die Bryologie Freude bereitet, aber jetzt ist auch mal wieder gut, ich werde den Entzug durchziehen.
Ganz so zuversichtlich bin ich allerdings nicht, ich fürchte ich könnte einfach bei einer anderen Droge landen...
Mal sehen.
Viele Grüße
Ingo
Ps: Kommentare und Korrekturen wie immer herzlich willkommen, das war völliges Neuland für mich und es würde mich nicht wundern trotz sorgfältiger Prüfung nicht doch irgendwo falsch zu liegen


