Servus zusammen, nachdem viele von euch ja immer noch schöne Funde machen, hab ich nochmal Motivation gesammelt gen Süden zu fahren um einen Spaziergang auf einer Hochebene bei Greding in der Oberpfalz zu unternehmen. Zwischen den Feldern fanden sich immer wieder kleine Wiesenabschnitte die vermutlich aufgrund geringer Bodenauflage über den Riffkalkbänken nur extensiv genutzt werden. Sicherlich ist aufgrund der nahen Felder schon mit einem gewissen Stickstoffeintrag zu rechnen, sodass ich keine große Hoffnungen auf Saftlinge oder dergleichen hatte- die gabs auch nicht- aber doch ein paar abwechslungsreiche Sächelchen. Los gings mit mehreren großen Hexenringen von Lepista panaeolus und personata, die ich nicht photographiert habe, da sie dieses Jahr einen Lauf gehabt zu haben scheinen und ich sie schon genug ablichten konnte- die letzten Jahre habe ich bewusst gesucht und nie gefunden, dieses Jahr waren die Lilastiele überall. Am Parkplatz, am Bolzplatz, am Wegrand, auf der Verkehrsinsel, crazy.
Doch ein Photo wert, und ein Erstfund, waren diese Schmierröhrlinge unter Fichte und Kiefer, die ich für ringlose Butterpilze (S. collinitus) halte:

Interessant fand ich dass sich die Poren auf den Stiel herunter ausdehnen


Vermutlich ein Hasenstäubling (Lycoperdon utriformis)

den gabs auch spätern nochmal in Gelb:

Lecker roch, wenn auch nicht ganz so intensiv wie der Marzipanfälbing (meine Nr 1 der Pilzgerüche bisher): der Marzipanschneckling unter Fichte, leider ein Einzelexemplar, sonst hätt ich ihn gern mal gekostet:


Mycena pura s.l. mit tollen violetten Stielen:

der Kaffee Gabeltrichterling (Pseudoclitocybe cyathiformis) mitten auf der Wiese?! gibts doch gar nicht. Eher doch ein Rötling mit seidigem Glanz. Leider nicht eingesteckt. Achja da fällt mir ein viele viele Weichritterlinge gabs auch, die ich nicht abgelichtet habe.

Gezonter Adermossling (Arrhenia spathulata) klein aber fein:


Goldmistpilz (Bolbitius vittelinus) im 70er Bob Stil, schon ein bisschen der Lack ab:

Und zum Schluss einer, der mir sehr gut gefallen hat wegen seinen extrem entfernt stehenden Lamellen und dem gelbroten Stiel. Da sie leicht gescheckt waren denke ich es sollte ein Düngerling (Panaeolus) sein; mit den Sporenmaßen könnte sogar der gewöhnliche Heudüngerling gut passen. Wobei ich nirgends Aufnahmen mit so entferntstehenden Lamellen finden konnte... LBM oder doch L(B)MAA? Aber ja, vieleicht hat ers halt gern luftig unter den Achseln?




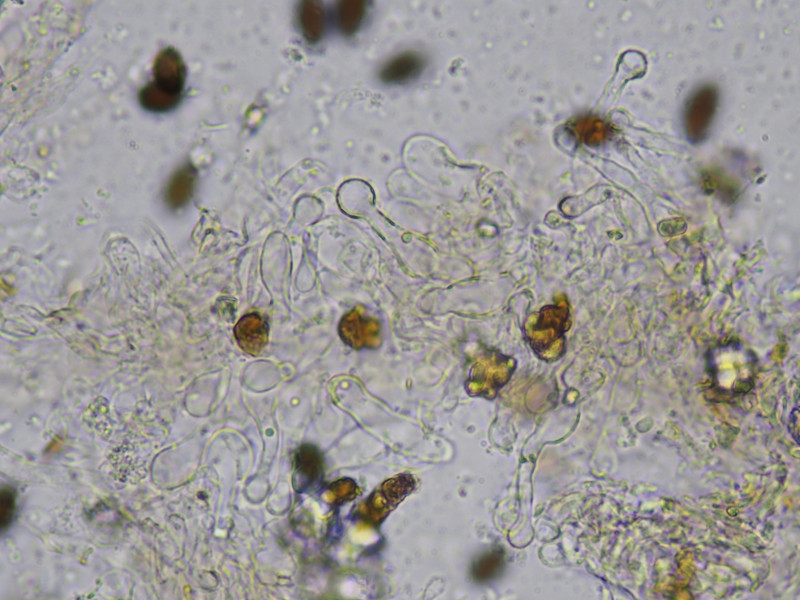
Cheilozystiden
gibts eigentlich noch Bowlinghallen in Deutschland? ich war seit Jahrzenten nicht mehr

Sporen:

(12.1) 12.8 - 14.1 (14.4) × (6.7) 6.8 - 8 (8.2) µm
Q = 1.7 - 1.9 (2) ; N = 18
Und da war sie auch schon wieder weg die Sonne

Habe die Ehre,
Ingo


