oder "Trauermückentöter traurig: er ist gar keiner, denn die Mücke war ein Psycho"
Servus zusammen,
wie ich in meinem Kommentar zu Christians Beitrag bereits erwähnte habe ich vor etwa zwei Wochen auch eine verpilzte Fliege, in meinem Fall eine Trauermücke (Sciaroideae), in einem meiner Anzuchttöpchen finden können. Leider blieb es eine einzelne, sodass sich meine Hoffnung der biologischen Schädlingsbekämpfung der diesjährigen Trauermückenplage mittels Entomophthora nicht erfüllte.
EDIT: nachdem ich nun die Mücke selbst im Vergleich zu einer frisch erlegten Trauermücke mikroskopiert habe stellte ich fest, dass es sich bei der befallen, auch wenn sie im Anzuchttopf neben den ganzen Trauermücken lag um eine andere Art, nämlich eine Schmetterlingsmücke (Psychodidae) handelt. Diese Gattung ist kenntlich an den behaarten Flügeln. Somit erklärt sich auch die fehlende Ausbreitung unter den Trauermücken und unter anderem meine anfängliche Fehl"bestimmung" des Parasiten siehe unten.
Ich konnte dennoch nicht umhin einen Bestimmungsversuch zu wagen. Dabei habe ich einiges über diese interessanten Parasiten gelernt. ZB. dass es sich bei einigen Arten streng genommen um eine Geschlechtskrankheit handelt, denn die befallenen Fliegen dieser Arten wirken auf Geschlechtspartner als supernormale Stimuli, wodurch es zu einer deutlich gesteigerten Kopulationsfrequenz kommt. Die Anziehungskraft bleibt wohl selbst bei einer bereits verstorbenen Fliege noch bestehen. So sorgt der Pilz effektiv für seine Verbreitung. Auch soll er das Verhalten der Fliegen dahingehend modifizieren, dass diese vor dem Ableben einen möglichst prominenten Platz über der Erdoberfläche anfliegen um die Chance der Verbeitung seiner Sporen nochmal zu erhöhen.
Zur Bestimmung eines solchen Parasiten sind neben der Kenntnis des Wirtsorganismus auch die mikroskopische Darstellung der Primär und Sekundärkonidien, der Konidienträger und evtl. steriler Zellen ("Zystiden") notwendig. Um die verschiedenen Typen der Konidien zu erhalten ging ich nach der Anleitung von S. Keller vor (den Artikel hat Thorben in Christians Post ja bereits verlinkt) und habe die Fliege zwischen zwei Objektträger in einen halboffenen Behälter gelegt. Allerdings habe ich die Fliege nicht schwimmen lassen wie dort beschrieben, da ich Angst hatte sie würde an den Rand des Behälters gezogen werden und die Sporen somit nicht auf meinem OT landen. Stattdessen habe ich in den Behälter etwas feuchten Zellstoff gelegt.
Zunächst einige Bilder zur Illustration (bereits mit korrekter Beschriftung):
Bild1

Befallene Schmetterlingsmücke (Psychodida spec.) auf Erdkrume
Bild2

Größe des Exemplars ca 1,5-2mm; das gesamte Abdomen ist überwuchert
Bild3
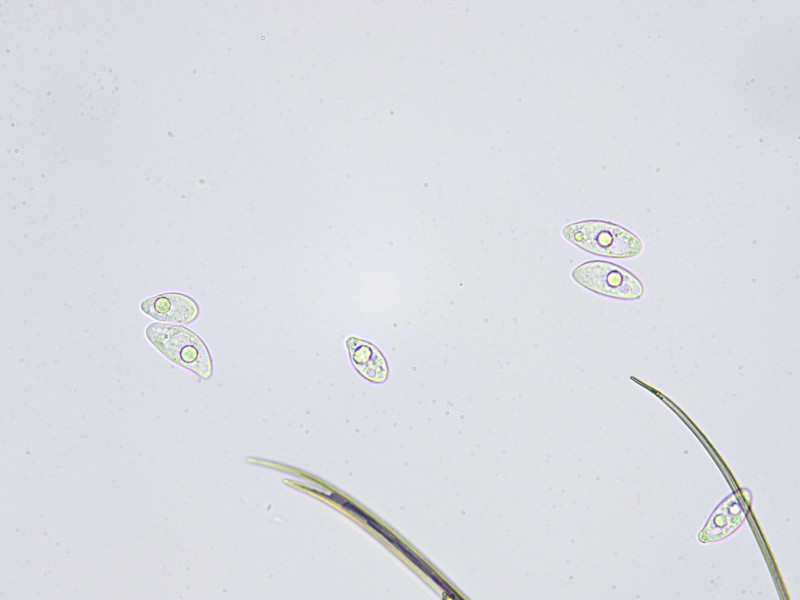
Sporenabwurf mit einigen Haaren der Schmetterlingsmücke (vermutlich vier Primär- und zwei Sekundärkonidien; ich habe etwas zu lange gewartet oder die Mücke war bereits zu lange tot)
Bild4
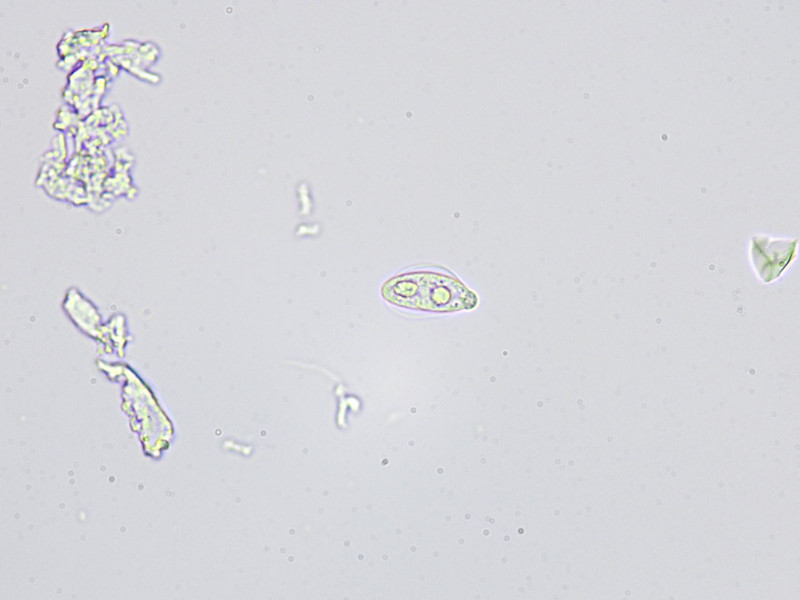
manche Primärkonidien schienen von einer Art hyaliner Hülle umgeben zu sein, leider habe ich keine Färbungen getestet um sie näher zu charakterisieren (Mucus etc).
Maße Primärsporen aus Abwurf: (22.9) 23.2 - 27.8 (28.8) × (9) 9.8 - 12.2 (12.8) µm Q = 2 - 2.5 (2.8) ; N = 25 Me = 24.9 × 11.2 µm ; Qe = 2.2 (incl. Papille)
Breite der Papille: 4 - 4.4 (4.7) × (3.3) 3.5 - 3.8 (3.9) µm Me = 4.2 × 3.6 µm
Bild5
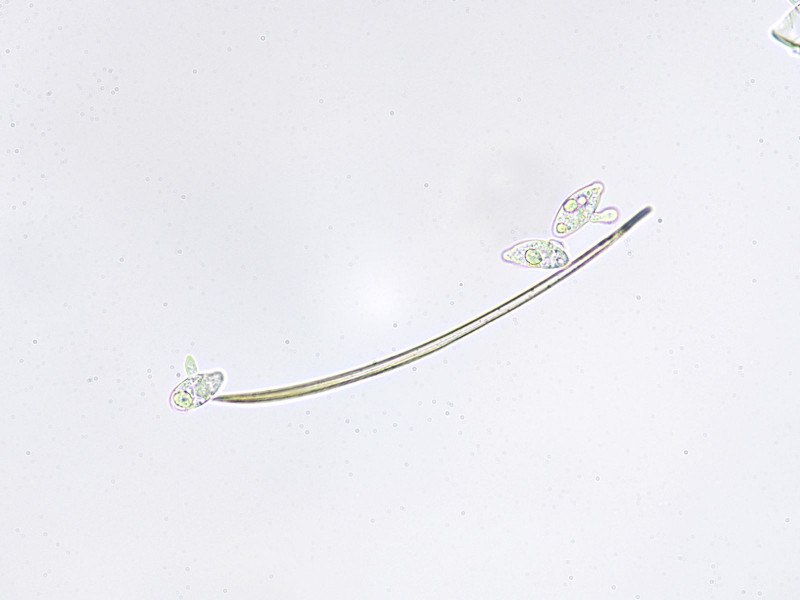
Primärkonidien mit Ausknospungen
Bild6
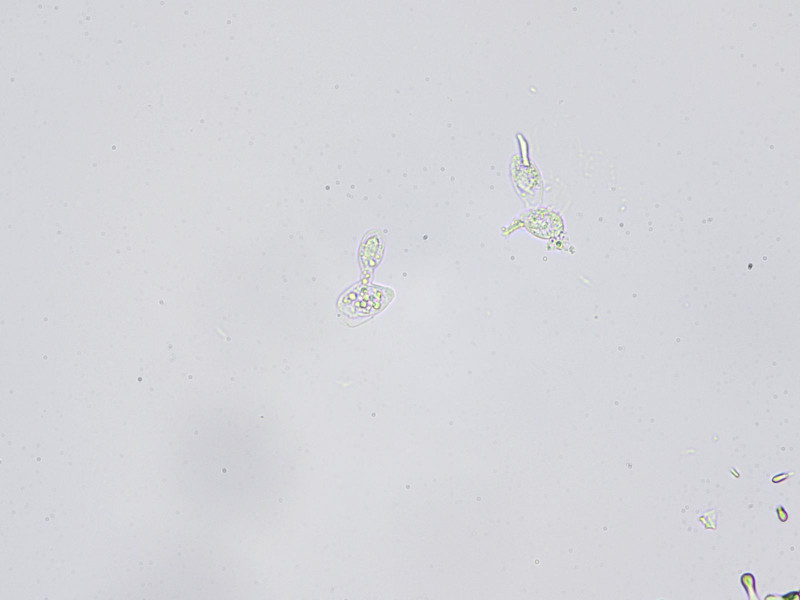
Sekundärkonidien in weiterer Entwicklung, es bildet sich auch hier eine Konidiophore aus, an der die Sekundärkonidie hängt
Bild7
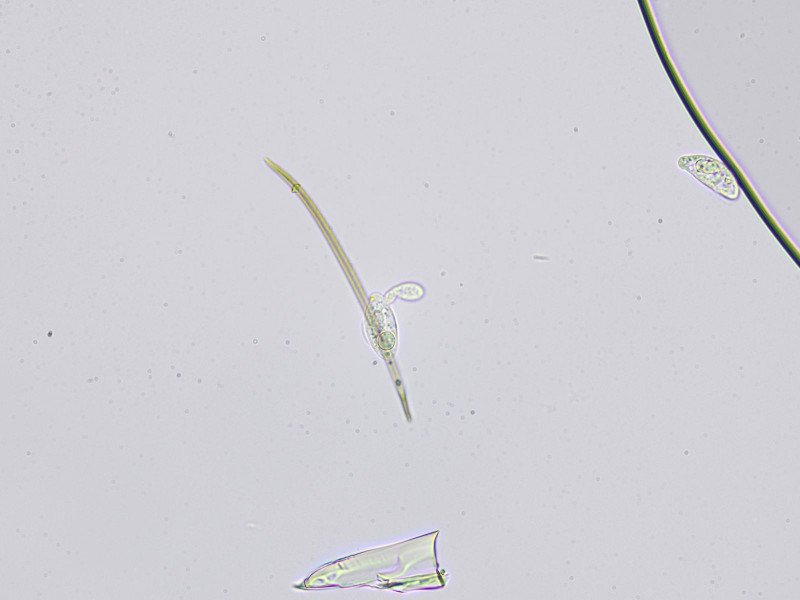
Bild8
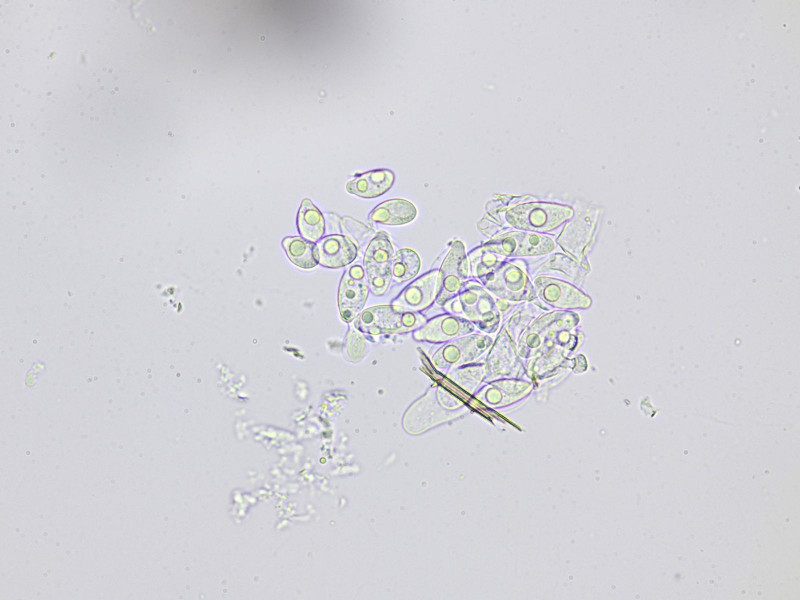
Primär und Sekundärkonidien (kleiner), im Hintergrund Zystide; aus Quetschpräparat.
Maße Sekundärsporen: 8.4 - 14.3 × 5 - 8.1 µm Q = 1.7 - 1.76 (1.8) ; N = 3 Me = 10.9 × 6.4 µm ; Qe = 1.7
Bild9
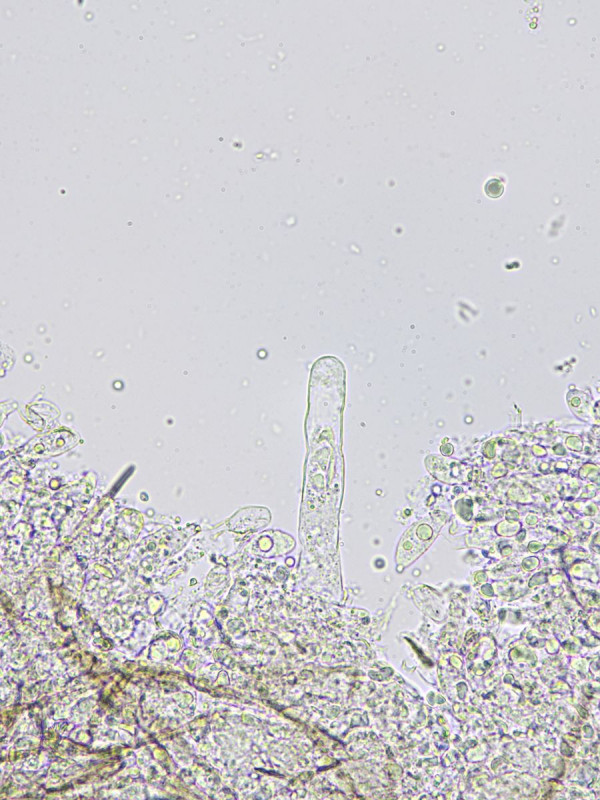
Zystide
Bild10
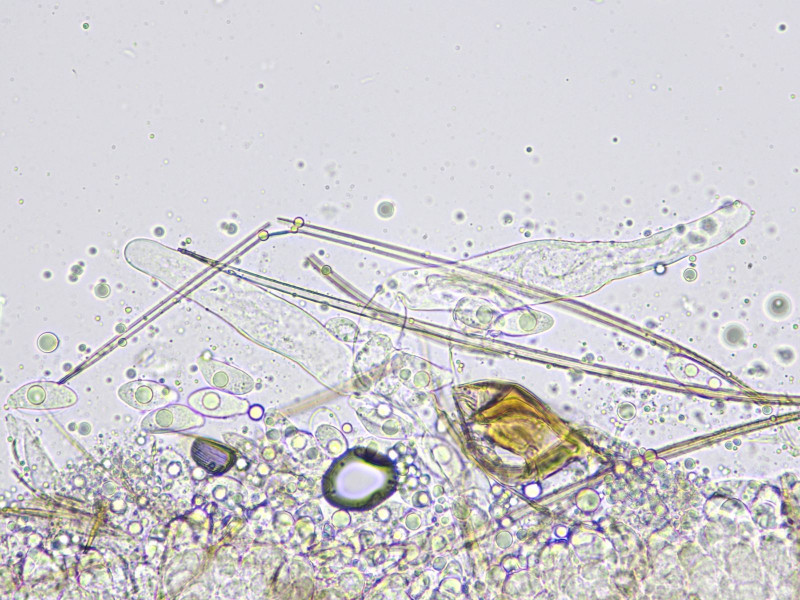
Zystiden; Dicke an der Spitze 6,9- 14,1µm; maximale Dicke 17,1- 22,2µm
Bild11
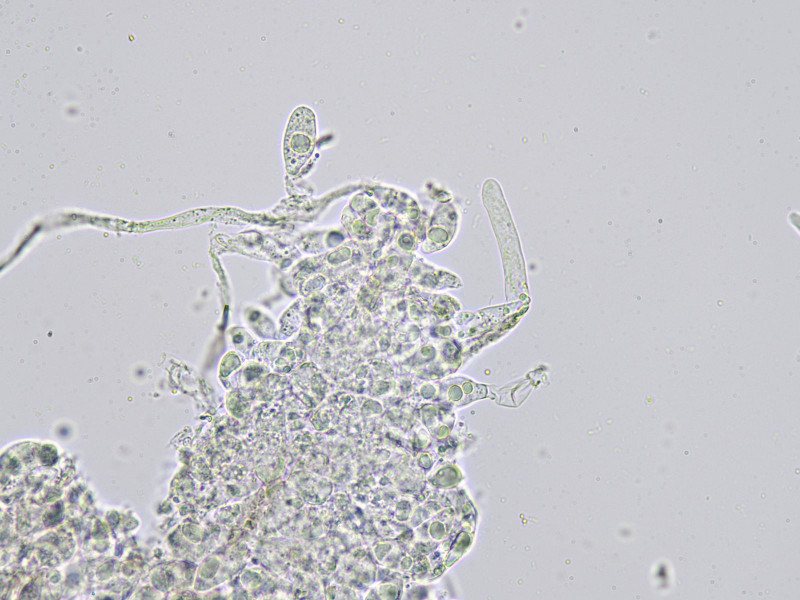
Bild12

Konidiophoren und Zystide. Leider gelang es mir nicht die Konidiophoren zu präparien.
Bild13
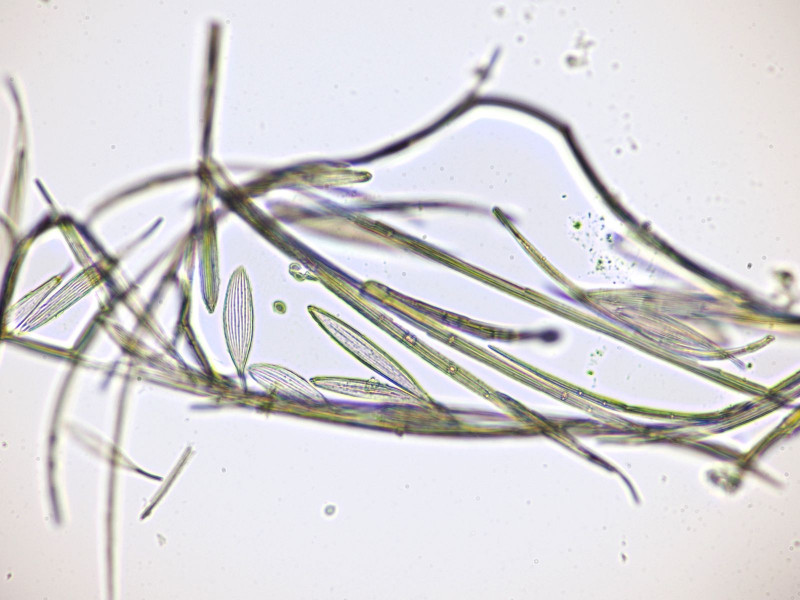
Schuppen der Schmetterlingsmücke (Psychodida) schließen eine Trauermücke (Sciarida) aus
Im Schlüssel von Keller & Petrini (2005) gelangte ich zunächst wegen der mutmaßlich unverzweigten Konidiophoren zu Entomophtoroideae. Nachdem ich die Konidien als "länglich elongiert" einstufte gelangte ich weiter zur Gattung Erynopsis - diese sollte jedoch keine Zystiden haben. Also zurück und nochmal ein Versuch mit "birnenförmig". Damit gelangt man zur Gattung Entomophaga. Die Sporen tragen eine prominente Papille, was passt und die Sekundärsporen entstehen seitlich und sind wie die Primärsporen geformt, was ebenfalls passt. Aber: auch hier sind keine Zystiden beschrieben. Sackgasse!
Gehe ich allerdings nun davon aus, dass ich nur Sekundärsporen (und Tertiärsporen, bzw sind manchmal auch zwei verschiedene Sekundärsporen beschrieben??) gefunden habe könnte es dann evtl doch eine Entomophtora s str. sein? (Die Primärsporen dieser Arten sind glockenförmig und daher würde diese Gattung ausscheiden) Leider sind die Beschreibungen die ich finden konnte sehr spärlich und Sekundärsporen sind zwar oft erwähnt aber fast nie beschrieben...
Nun für diese Annahme finde ich, wenn ich über das Substrat Sciaroideae in allen meinen mitterweile angesammelten Artikeln rückwärts suche nur eine einzige Art: Entomophtora trinucleata. Leider konnte ich keine Kerne innerhalb der Konidien erkennen und besitze auch keine Kern-Färbemittel, sodass ich diese steile Hypothese nicht überprüfen kann. Außerdem fand ich keine Sporenbeschreibung zu dieser Art. Weiterhin ist es ja durchaus denkbar, dass die Arten zwar hoch wirtsspezifisch sind, jedoch die Wirte auch mehrere Parasiten "beherbergen" können (auch wenn sie bisher noch nicht beschrieben wurden).
Also: alles sehr sehr spekulativ!
EDIT: Der Fehler liegt bereits ganz am Anfang: es muss sich um verzweigte Konidienträger handeln.
Damit landet man dann bei der Gattung Erynia und hier passen dann die Sporen auch und alles hat seine Richtigkeit. Es sind also Primärsporen und Sekundärsporen. Auch die Zystiden passen zur Gattung. Zudem war die usprüngliche Bestimmung des Wirtes als Sciarida falsch, denn es handelt sich um eine Psychodida.
Mit der Sporengestalt, der Papille und den großen Zystiden kommen nach Keller
(in Arthropod-pathogenic Entomophthorales from Switzerland. IV.Second addition 2012)
vier Arten infrage:
Erynia fluvialis S. Keller 2007: scheidet aus da: Primary conidia (17) 19.2±20.8 (24) x (7) 8.4±9.4 (11) mm, Q = 2.19±2.4; -> hier deutlich größer
Erynia thurgoviensis S. Keller sp. nov 2012. : Primary conidia (22-) 26.5-27.0 (-30) x (10-) 10.6-10.7 (-12) pm, Q 2.49-2.54 etwas schmaler als hier, evtl noch im Rahmen? Papilla narrow, 3-4 pm wide: hier etwas weiter gemessen, Wirt in der Erstbeschreibung: Psychodidae indet. -> würde passen
Erynia ovispora (Nowakowski) Remaudiere & Hennebert 1980: Primary conidia (22-) 25.0 (-28) x (11-) 12.5 (-15) pm,
Q 2.0 (1 series, n 50), ellipsoidal (Plate 3, fig. 7). Cystidia powerful, subterminally enlarged; host Psychodidae -> passt insgesamt besser v.a. wegen der breiteren Konidien und breiteren Papille
E. variabilis wird noch als ähnliche Art aber mit anderen Sporen und Zystiden erwähnt, von ihr habe ich leider keine Beschreibung/Daten gefunden
Damit würde ich die hier gefunde Spezies erstmal als Erynia cf ovispora ex Psychodida spec. benennen.
Mit einer gewissen Restunsicherheit cf da ich ich die Mikroskopie bei diesem persönlichen Erstfund leider noch nicht umfassend hinbekommen habe und einige Strukturen nicht oder nicht ausreichend beurteilen konnte. Aber zumindest die beurteilbaren Befunde sind mit dieser Art gut vereinbar.
Ich freue mich den Fall nicht gleich aufgegeben zu haben und habe wieder einiges gelernt.
Kommentare wie immer willkommen,
viele Grüße
Ingo
PS: Ich habe mich entschlossen den Post in seiner ursprünglichen Form (die ich bereits vor 2 Wochen aufgesetzt hatte) mit Editierung zu veröffentlichen um die Bestimmungsschritte und meine Probleme dabei nachvollziehbar zumachen, sodass sie evtl. anderen Foristen bei ihren Bestimmungen eine Hilfe sein können. Damit es nicht zu konfus wird habe ich die Bilder samt Beschriftung jedoch akualisiert.


