Servus zusammen,
an Ostern war ich auf einem Familientreffen auf der (schwäbischen) Alb bei Wittstaig. Zumindest an einem Tag war das Wetter für einen Spaziergang gut genug, sodass wir uns aufmachten eine der vielen Burgen zu erklimmen. Natürlich hielt ich auf dem Weg auch die Augen offen, ich finde es immer spannend andere Habitate zu entdecken. In diesem Fall ein submontaner Wald auf Kalk (Weißjura) mit westseitig Buchen und ostseitig hauptsächlich Fichten und Tannen. Offenbar war das Wetter die Wochen zuvor günstig, denn wir konnten einige schöne Funde machen.
Ich fange gleich mit unserem Ziel an, damit ihr eine Ahnung bekommt wie es dort aussah:


Blick von der Burg Hohengundelfingen auf Wittstaig, einem Dorf welches im Wesentlichen aus dem Gasthaus und fünf weiteren Häusern besteht.
Aber zurück ins Tal: trotz der Höhe von ca 700 müNHN war die Botanik dort oft schon in voller Blüte:


So die schönen Pestwurzen und im angeschwemmten Kalksinter zwischen Wasserminze zwei Spitzmorcheln (Morchella elata agg.) Dort hätte ich nicht damit gerechnet, aber was verstehe ich schon von Morcheln.

zwei Erdkröten auf Honeymoon

Gyromitra ancilis auf Fichtenstümpfen fanden wir mehrfach am Wegrand


Diesen schönen Bechern im Sauerklee konnte ich zunächst keinen Namen geben, da die typsichen Wirte auf den ersten Blick nicht vorhanden waren.
Zu Hause konnte ich sie als aufgrund der überwiegend vier Kerne als Anemonenbecherlinge (Dumontinia tuberosa) bestimmen.
Jetzt beim Einfügen der Fotos habe ich sie auf dem ersten Bild mittig entdeckt..  (leider mit quengelndem Kind im Nacken nicht allzu scharf geworden)
(leider mit quengelndem Kind im Nacken nicht allzu scharf geworden)

Dann folgte für mich das Osterei schlechthin, ein lange ersehnter Erstfund: leuchtende Prachtbecher (Caloscypha fulgens). Mehrmals habe ich sie bei mir zu Hause schon versucht gezielt zu finden, immer erfolglos. Im Grünstreifen neben dem Weg, wo kurz vorher der Balkenmäher gestutzt hatte entdeckte ich sie dann. Hätte der Mäher ihre leuchtenden Bruchstücke nicht überall verteilt hätte ich sie womöglich übersehen.. aber zum Glück waren es so viele, dass ich genügend intakte für eine Fotosession fand.

Dafür habe ich dann sogar mein Stativ aufgebaut und den Rest der Gruppe voranziehen lassen, zum Glück hatten sie so viel Verständnis für den verrückten Pilzler, der irgendwas von 'den findet man nur einmal im Leben' faselte. Jaja...
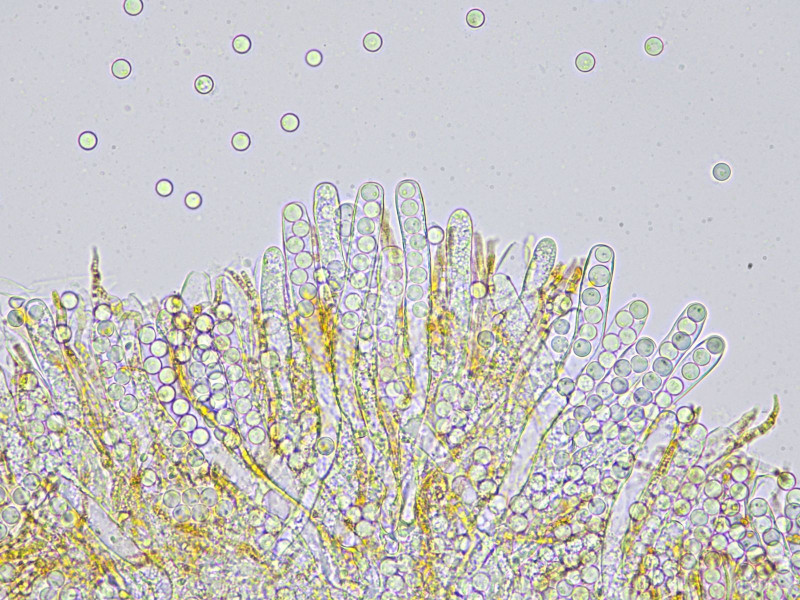

Das Exzipulum verfärbt bei Verletzung blau. Das lässt sich auch unter dem Mikoskop beobachten.
Von diesem schönen Fund noch völlig high, ich meine erleuchtet, folgte auf einem Fichtenstumpf gleich der nächste Kracher:




Diese Lorchel hätte ich makroskopisch als Gyromitra gigas angesprochen. Das große Exemplar habe ich mitgenommen, wie befürchtet ist es jedoch noch zu jung. Na mal schaun ob es noch nachreift. Solange bleibt das natürlich Spekulation. Das wäre für mich auch ein Erstfund, Jörg Hannes2 , Du findest die Teile doch regelmäßig- könnte das hinkommen?
Auf dem Abstieg gabs noch ein paar Flechten:




Wenn ich nachdenke wie lange ich Graphis scripta agg. zu Hause gesucht habe, bis ich sie endlich einmal fand.. und hier waren gesamte Buchenstämme voll davon, toll!
Sowie an einer ausgewaschenen Felsgrotte diese adretten Knöpfle (man verzeihe mir den stümperhaften Versuch den Lokalkolorit wiederzugeben)


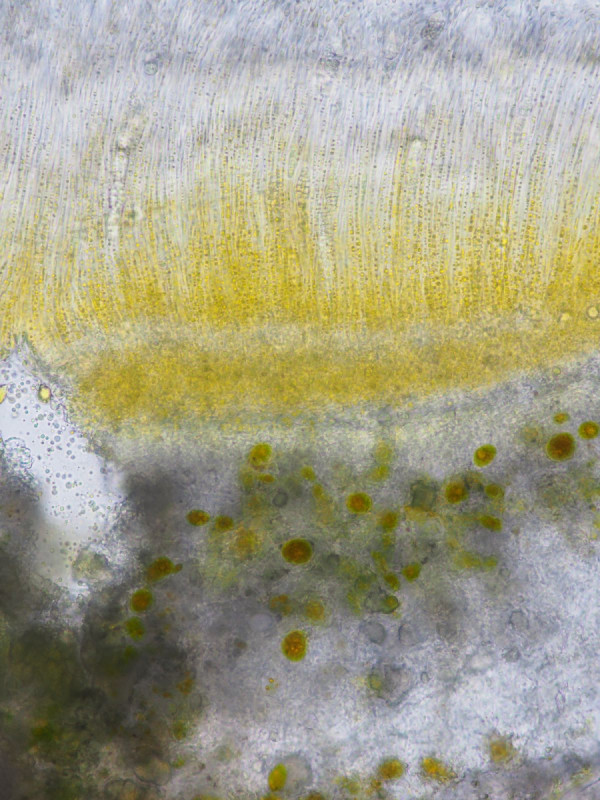
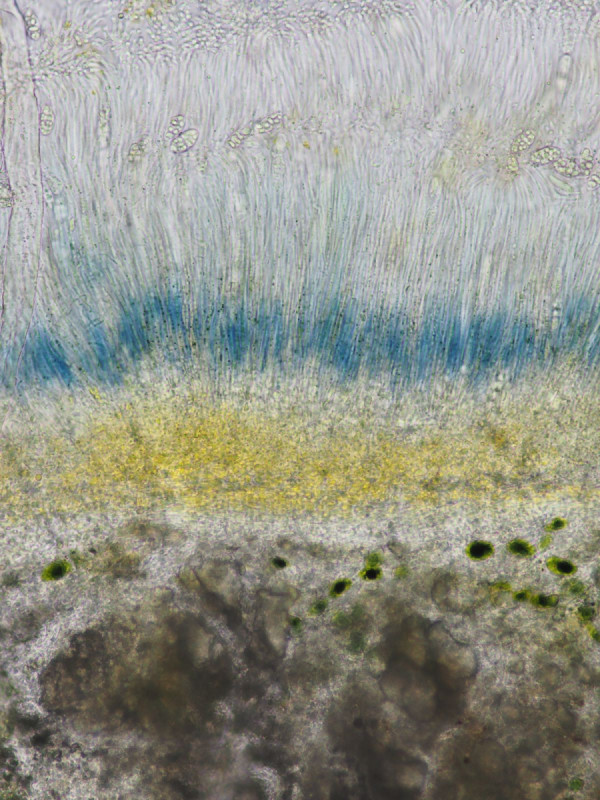
links nativ, rechts Lugol
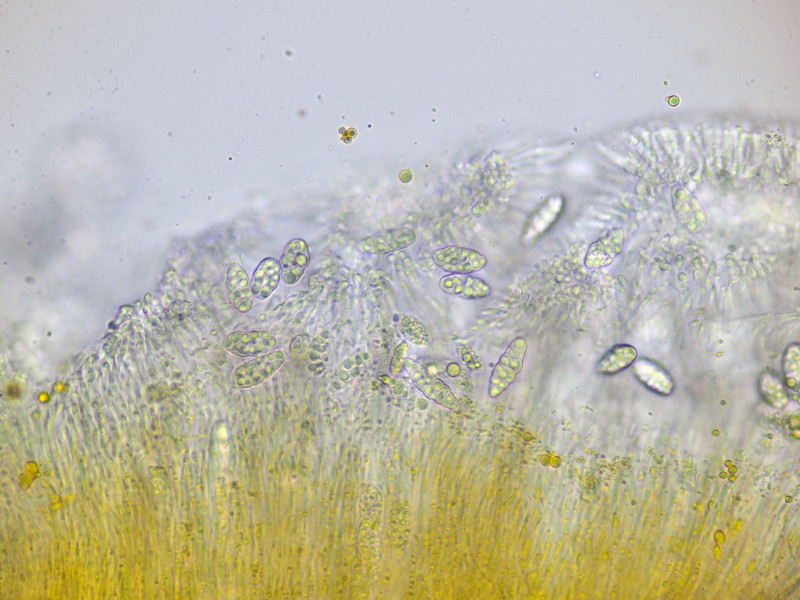
Sporen 16.6 - 23.8 (24) × 7.9 - 9 (10.2) µm Q = (1.6) 1.8 - 3 (3.1) ; N = 9
Auch wenn sie im Schwäbischen gefunden wurden hören sie wohl auf den Namen "Jenaer Grubenflechte" (Gyalecta jenensis) und sind nicht selten an feuchten Karbonatgesteinen.
Bestimmt habe ich mit Wirth/ Flechten BW. Die Beschreibung passt gut, es gäbe wohl noch einige Verwechslungspartner, die aber im Vergleich viel seltener wären.
An dieser Stelle muss ich mich bei Martin KaMaMa entschuldigen, dass ich einfach so in seiner Nachbarschaft wildern war ohne Bescheid zu geben- aber ein Treffen war leider wegen Krankheit, Autopanne und Familienchaos nicht im Bereich des Realistischen.. mir hat es dort aber sehr gut gefallen, vor allem die vielen Kalkmagerrasen haben mich angelacht und irgenwann möchte ich dort nochmal im Herbst hin! Vielleicht geht dann mal was zusammen?

Zum Abschluss noch ein paar Farbtupfer: Kü(h)chenschellen (Pulsatilla spec.)
Danke fürs Mitkommen, Korrekturen und Kommentare wie immer willkommen!
Ingo


