Hallo zusammen
Nachdem gestern der erste Schnee fiel, ist die Saison hier wohl so ziemlich am Ende.
Immerhin konnte ich letzte Woche noch zweimal auf die Pirsch gehen, und fand einige spannende Sachen.
Achtung, der Beitrag ist wieder schaurig trichterlingslastig. Deshalb zuerst alles andere:
1: Eine Galerina im Gras

Diese kleinen braunen Pilze wuchsen zu Hhunderten auf einer Magerwiese.
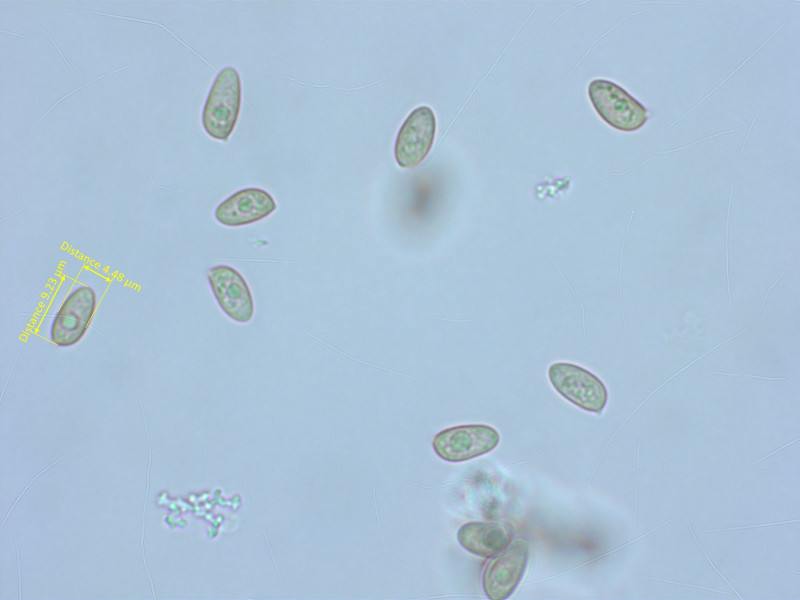
Die Sporen sind minimal rauh.
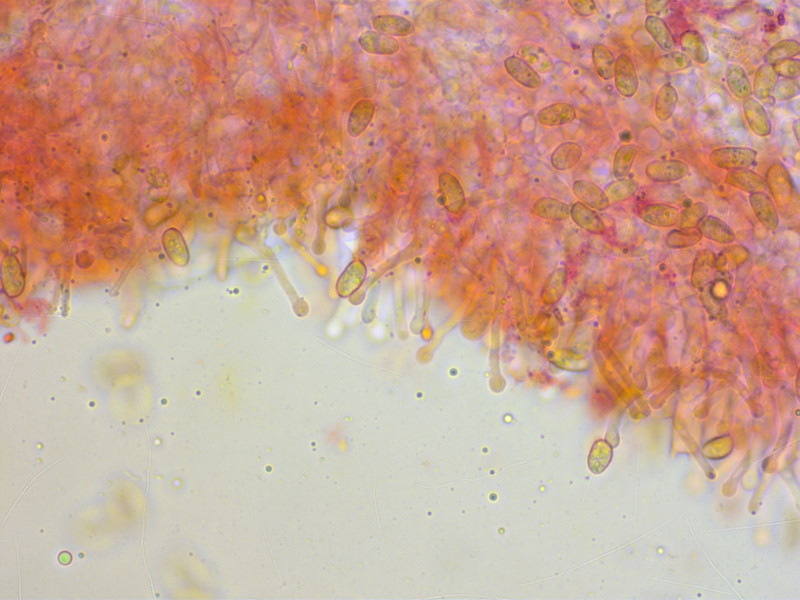
Die Cheilozystiden sind tibiiform, typisch für eine Gruppe von Galerinas.
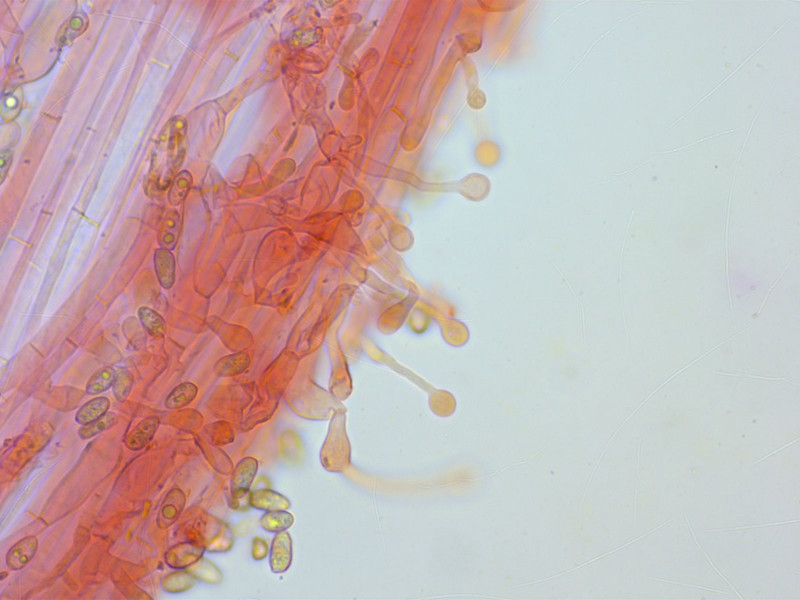
Kaulozystiden ebenso.
Damit ist das nichts besonderes, aber mit schönen Mikromerkmalen: Galerina graminea.
2: Ein gelber Schirmling

Am Standort kommen die gelben Farben nicht richtig zur Geltung.

Hier sieht man es dann besser, farblich fast wie eine Floccularia straminea.
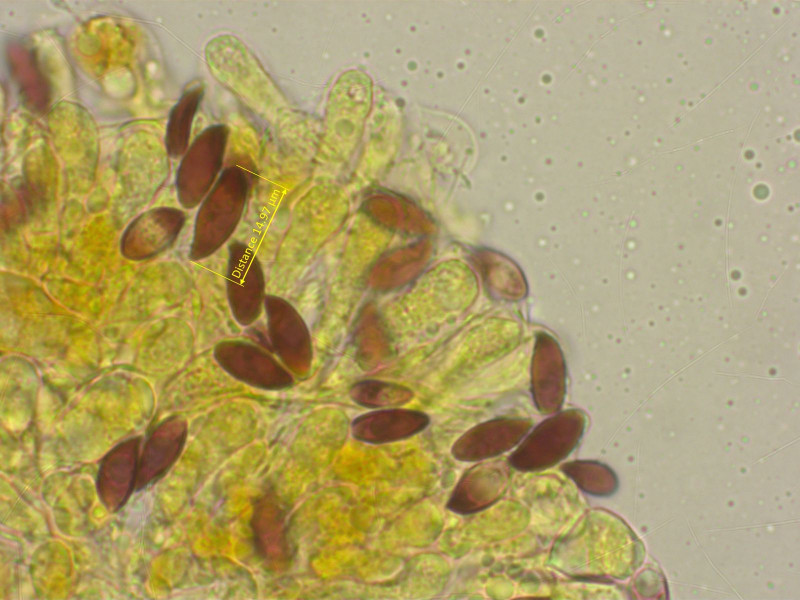
Die Sporen sind recht gross und spindelig.
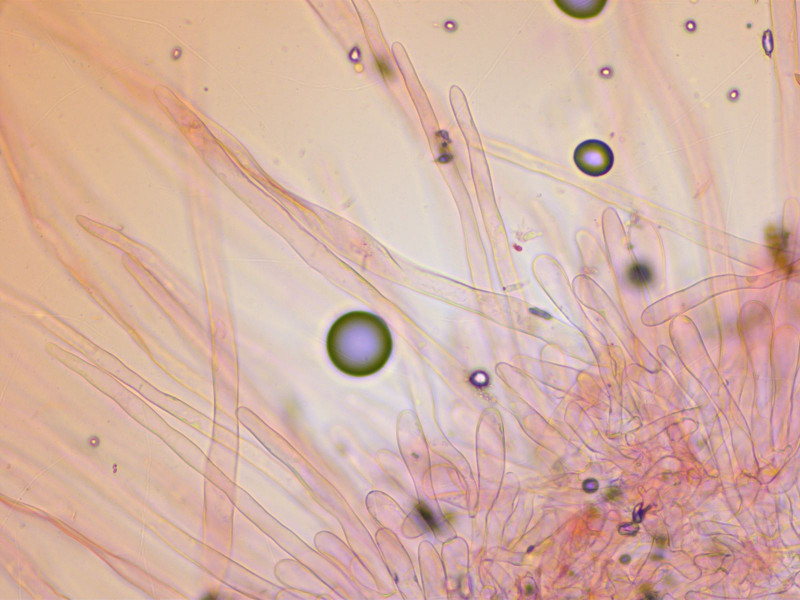
Die HDS besteht aus enorm langen Haaren.
Mit dem wolligen Stiel und den gelben Farben schreibe ich jetzt mal Lepiota ochraceosulfurescens dran.
Viele halten es für eine Varietät von Lepiota clypeolaria, wer Recht hat weiss der Pilz besser als ich.
3: Ein Tellerling

Aufgrund des starken Mehlgeruch hatte ich schon im Feld den Verdacht, dass es eine Rhodocybe sein könnte.
Farblich käme es in die Nähe von Rhodophana nitellina, aber die Lamellen sind zu kräftig gefärbt.
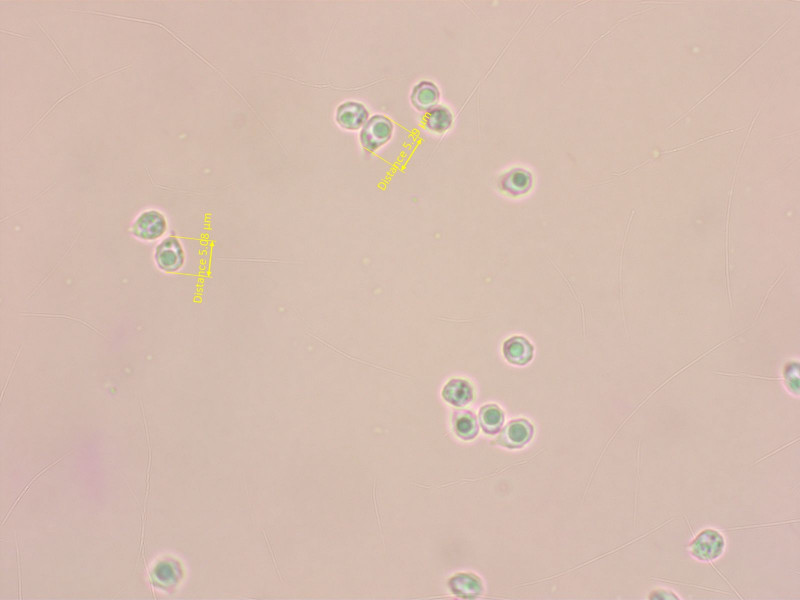
Die Sporen bestätigen den Verdacht, sie sind deutlich höckerig. Aber zu klein für nitellina.
Die Art wurde lange in Frage gestellt und als Synonym von Rh. nitellina gehandelt, aber inzwischen hat sich gezeigt dass es eine gute Art ist: Rhodophana melleopallens.
4: Ein kleiner Sägeblättling

Nur zwei Exemplare, aber die mussten mitkommen.
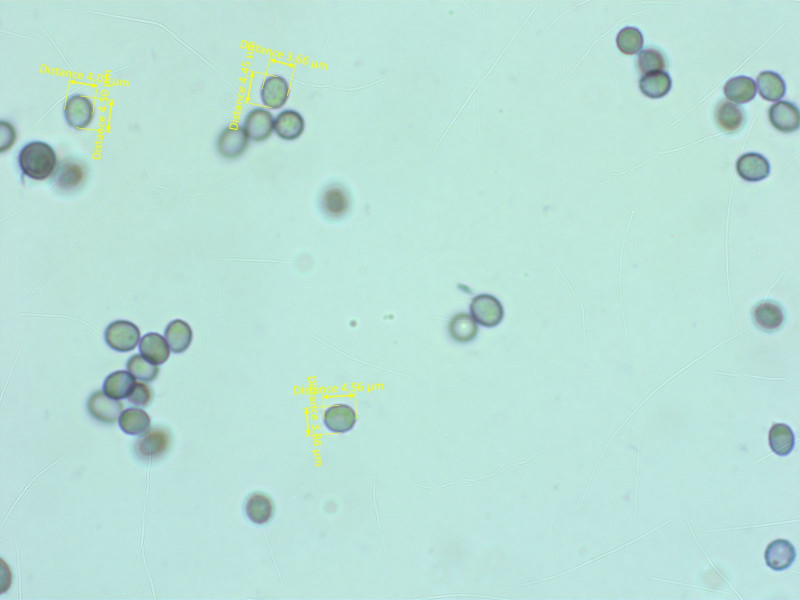
Die Sporen sind rundlich, deutlich amyloid und feinwarzig.
Nach Petersen et al. 2004 komme ich auf Lentinellus micheneri.
5: Ein rätselhaftes Graublatt

Dieser Pilz hat mir viel Kopfzerbrechen bereitet. Er riecht deutlich nach Mehl und hat einen wurzelnden Stiel.
Damit würde es ganz gut zu Tephrocybe rancida passen. Aber irgendwas gefiel mir nicht, also kam er mit.
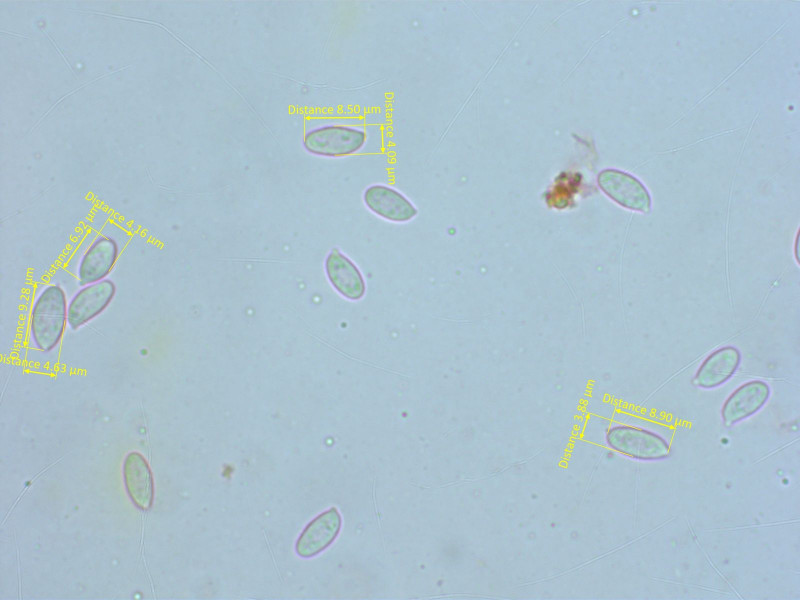
Die Sporen sind elliptisch, subzylindrisch oder leicht spindelig.

Basidien stark siderophil.
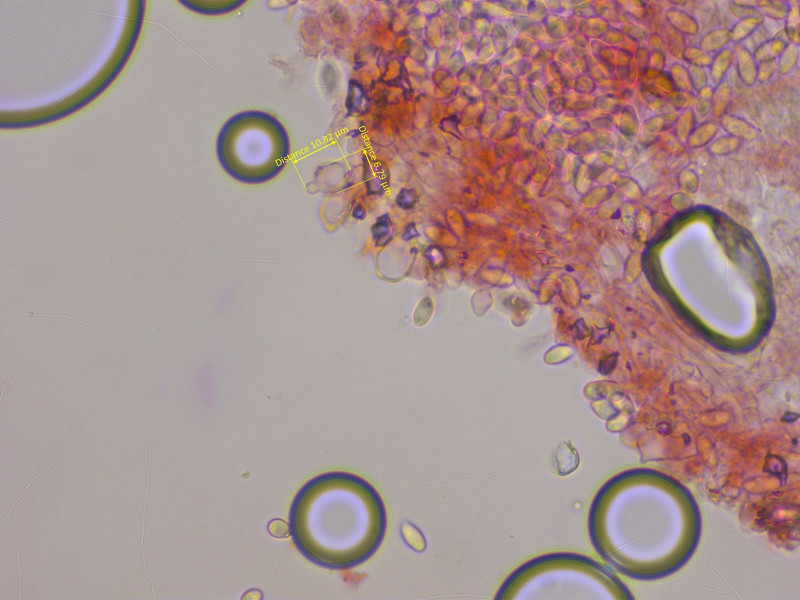
Aber: Die Lamellenschneide ist steril und voller kleiner Cheilozystiden. Sowas hat Tephrocybe rancida nicht.
Wenn man genau nachliest, findet man im Gröger und Ludwig aber eine Form mit Zystiden. Die wird es wohl sein:
Tephrocybe rancida fm. submarginata.
So, nun komme ich zu den Trichterlingen. Loona hat hoffentlich eine Meinung dazu, denn ich habe im Moment mehr Fragen als Antworten.
6: Ein klarer Fall

Diesen Spätherbst ein Massenpilz. Ich fand den Geruch chemisch, lernte dann aber im Ludwig dass Mäuseurin so riecht (woher soll ich das wissen???)
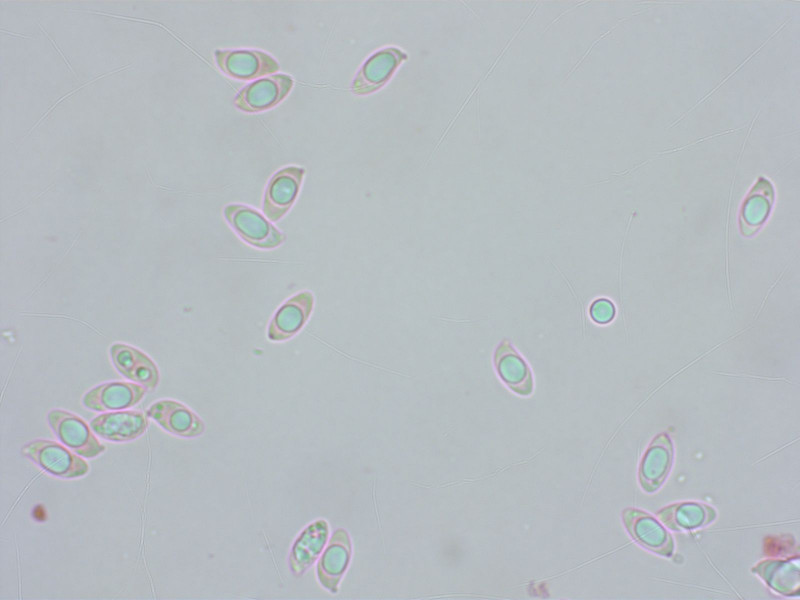
Mit den spindeligen Sporen ist es eindeutig Atractosporocybe inornata.
7: Ein bereifter Wiesentrichterling

Der wuchs auf einem Campingplatz im Gras. Geruch süsslich.
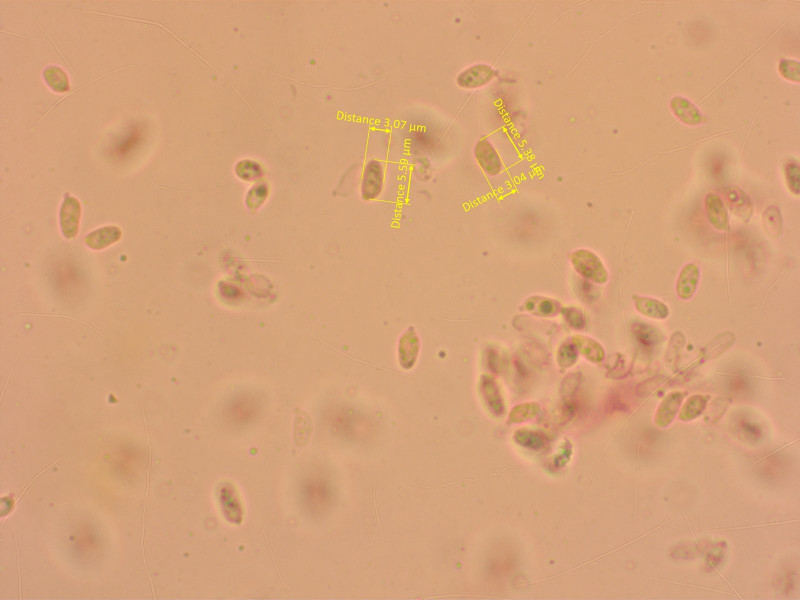
Sporen klein und schlank.
Pigment intraparetial und vakuolär.
Ich lande wieder bei Clitocybe rivulosa, aber mit einigen Fragezeichen.
8: Hemilyophylloider Trichterling 1

Dieser hier hatte aber einen kräftig spermatischen Geruch. Nur schwach hygrophan.
Habitat: Kiefernwald unmittelbar neben einem Trockenrasen.
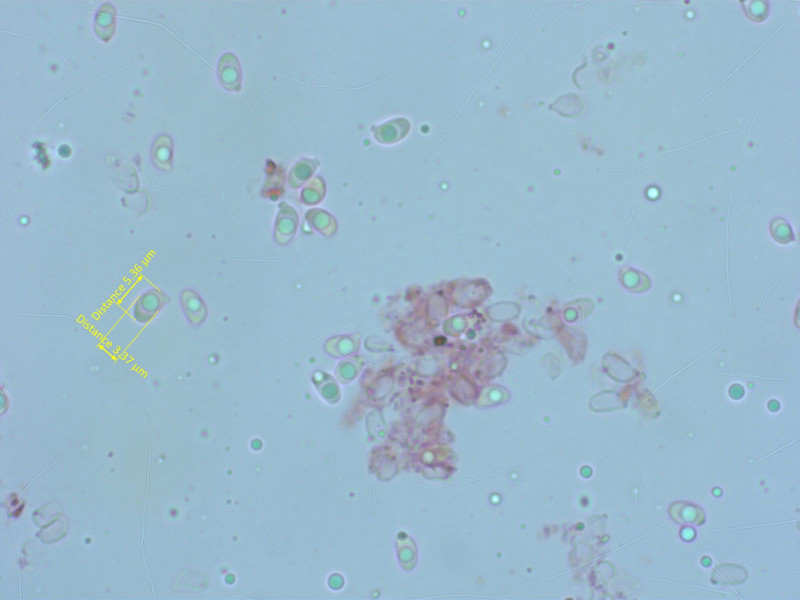
Sporen klein und recht breit. Pigment intraparetial, diffus bräunlich intrazellulär und stellenweise vakuolär.
Die Basidien sind wieder einmal inkonstant und schwach siderophil.
Einen Namen kann ich nicht vorschlagen...
9: Hemilyophylloider Trichterling 2

Die wuchsen nicht weit entfernt, sind eher strohgelb, riechen süsslich-aromatisch. Hygrophan, zu creme-weiss ausblassend.
Habitat: Kiefernwald unmittelbar neben einem Trockenrasen.
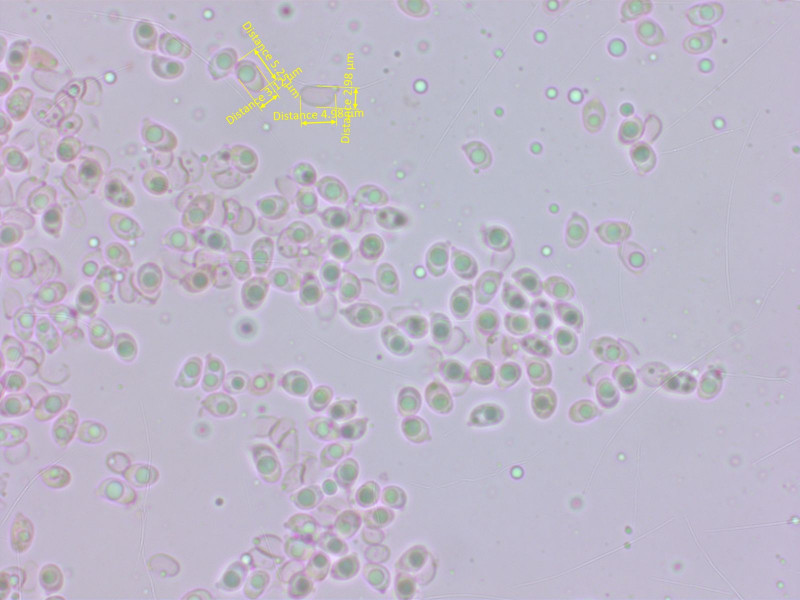
Die Sporen sind eigentlich gleich wie bei 8. Pigment blass intrazellulär. Basidien wieder schwach siderophil.
Auch hier habe ich keinen sicheren Namen. Ich meine das wurde früher gerne als Clitocybe brumalis bezeichnet.
Vielleicht Clitocybe ochroleuca Schopfer nom. prov.?
10: Brauner Trichterling 1

Diese Gruppe von Trichterlingen roch schwach angenehm. Hygrophan, trocken hell graubraun.
Habitat: Kiefernwald unmittelbar neben einem Trockenrasen.
Wichtig könnte der kräftige Stiel bei ausgewachsenen Exemplaren sein, bis 8 mm dick und oft abgeplattet.
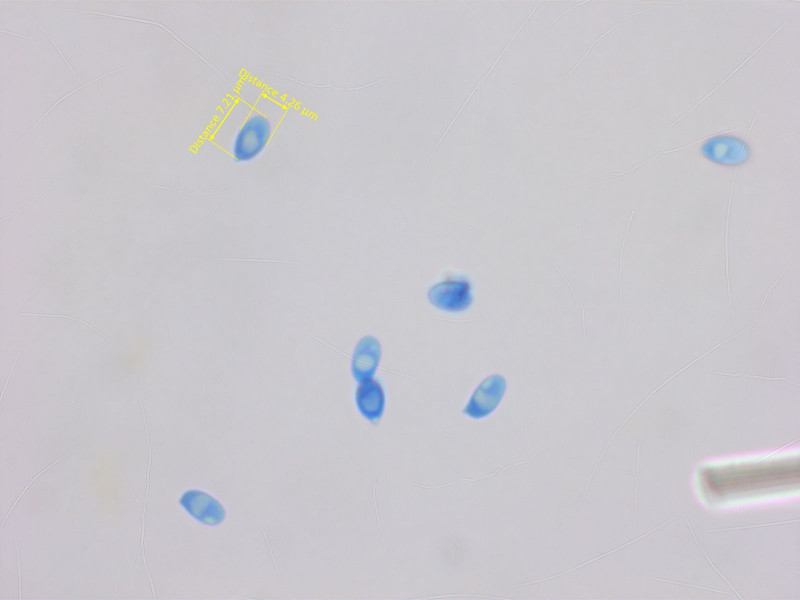
Sporen cyanophil, mittelgross.
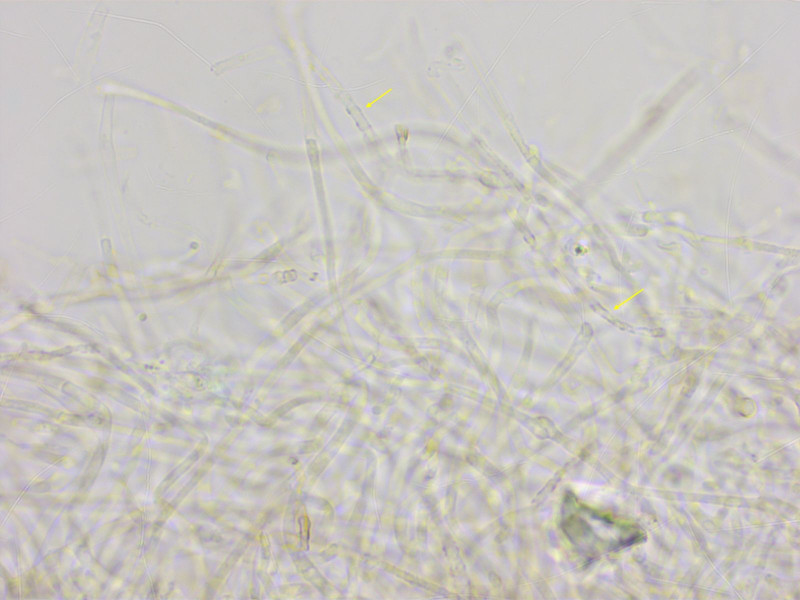
Pigment mehrheitlich intrazellulär, aber stellenweise auch deutlich inkrustierend.
Es muss wohl irgendwas aus der Gruppe um Clitocybe metachroa/strigosa sein. Aber bei jeder Art passt etwas nicht:
- metachroa hat kein inkrustierendes Pigment
- metachroides sollte einen fast kahlen Stiel haben
- strigosa sollte eine striegelige Stielbasis haben, was hier nicht der Fall war (nicht leicht filzig)
- fennica ist eine Geisterart mit etwas kleineren Sporen, evtl. identisch mit metachroides
- amarescens hat wieder kein inkrustierendes Pigment.
Was ich somit bisher weiss: Es ist ein Trichterling.
11: Brauner Trichterling 2

In vielerlei Hinsicht ähnlich wie Nr. 10. Aber insgesamt schlanker, und der Stiel ist bei einigen Exemplaren fast kahl.
Habitat war ein Mischwald aus Kiefern und Flaumeichen. Geruch schwach, angenehm.
Hygrophan, trocken hell graubraun. Der Stiel war kaum dicker als 3 mm.
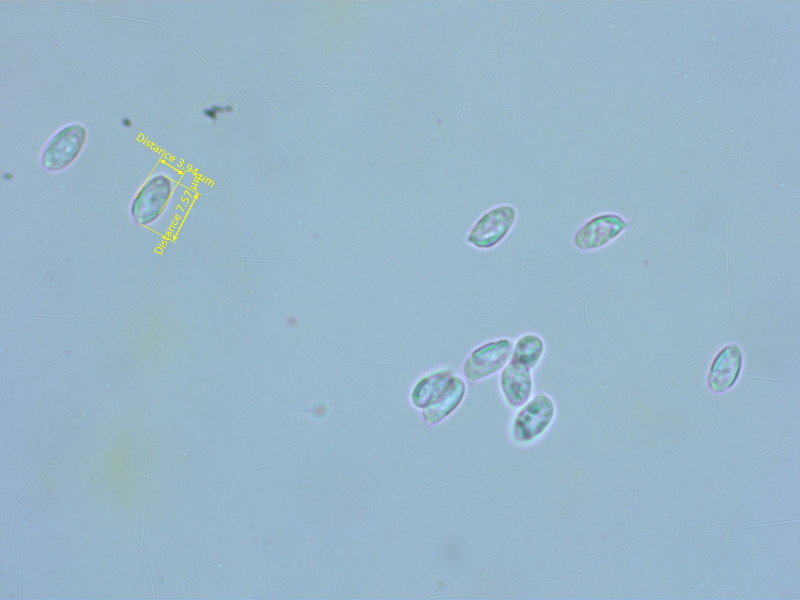
Sporen ähnlich wie bei 10, aber mit einer leicht spindeligen Tendenz.
HDS wie bei Nr. 10, intrazellulär pigmentiert mit stellenweisen Inkrustierungen.
Hier gefällt mir Clitocybe metachroides recht gut.
Bin gespannt auf Feedback.
Viele Grüsse
Raphael
![]()


