Liebe zahlreiche Trichterlings-Freunde
Der Spätherbst bringt hier in der Gegend immer sehr viele trichterlingsartige Pilze. Mit der Bestimmung habe ich nach wie vor meine liebe Mühe.
Vielleicht hat ja jemand ein paar Ideen ( Loona )
1:

Wie man sieht wuchsen sie im Kiefernwald, in grosser Zahl. Es gab hunderte davon.
Umso beängstigender, dass es offenbar keinen Namen dafür gibt.
Letztes Jahr habe ich eine Kollektion vom gleichen Ort sequenzieren lassen.
Ergebnis war eine unbeschriebene Art im "hemilyophylloiden Clade" von Clitocybe.
Ob das hier wirklich wieder die gleiche Art ist, wird sich zeigen.
Geruch übrigens schwach pilzig-mehlig. Nur schwach hygrophan.
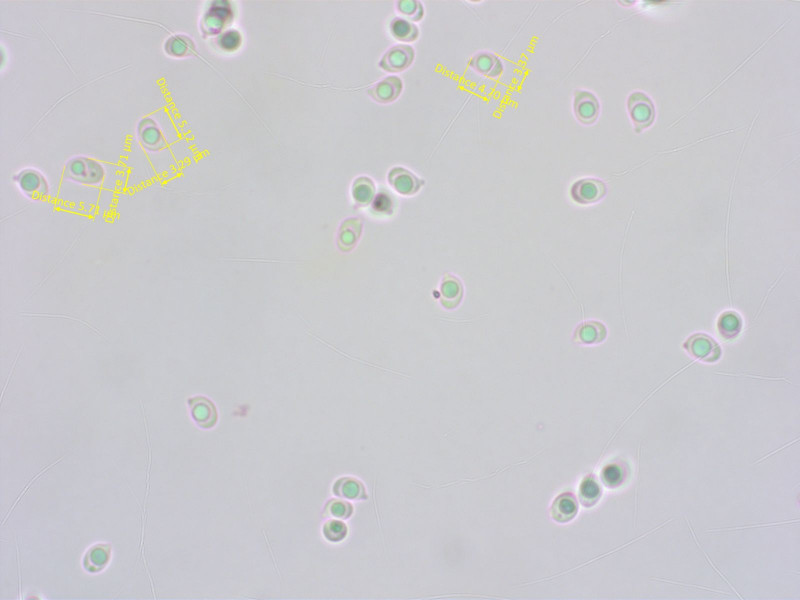
Die Sporen sind recht klein und eher breit elliptisch. Das scheint in diesem Clade öfter vorzukommen.
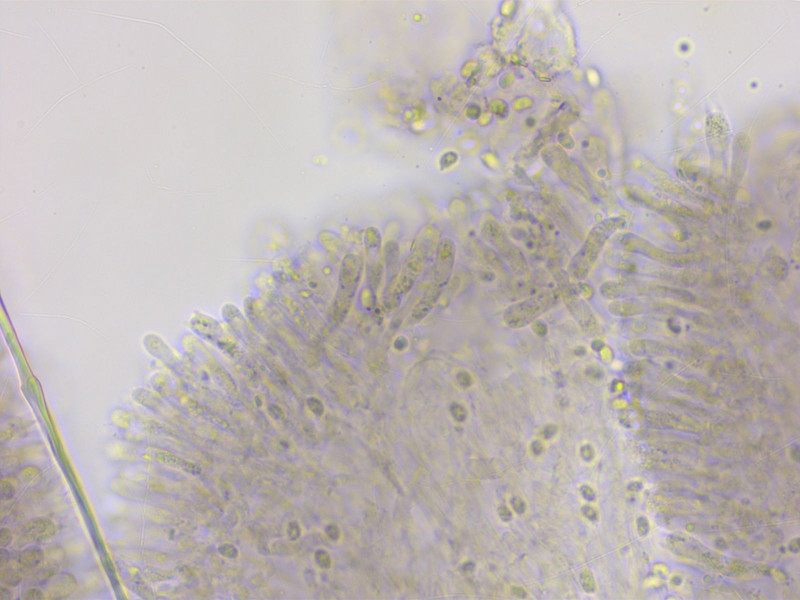
Und dann das typische Phänomen: Die Basidien sind stellenweise siderophil, aber nicht überall und nie so stark wie bei einem echten Lyophyllum.
Schnallen überall häufig.
2:

Ein stark bereifter Tricherling. Der Standort war eindeutig im Wald (Pinus sylvestris), Arten des Graslandes kann man ausschliessen.
Einzelne Laubbäume standen da auch in der Nähe, Alnus sp. und Quercus pubescens.
Geruch süsslich-aromatisch.
Hier passt mir irgendwie keine der bereiften Trichterlings-Arten so richtig, vor allem wegen der sehr kleinen Sporen und dem Geruch.
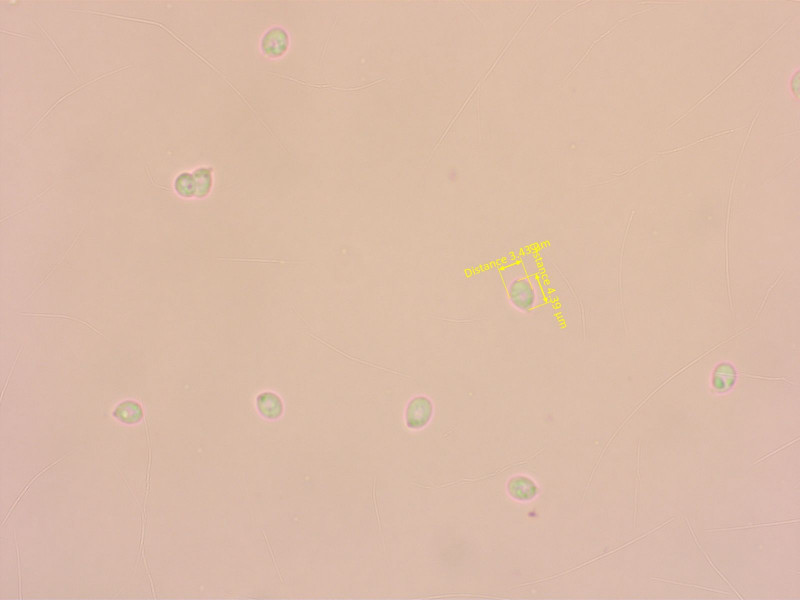
Die Sporen sind wieder klein und breit elliptisch.
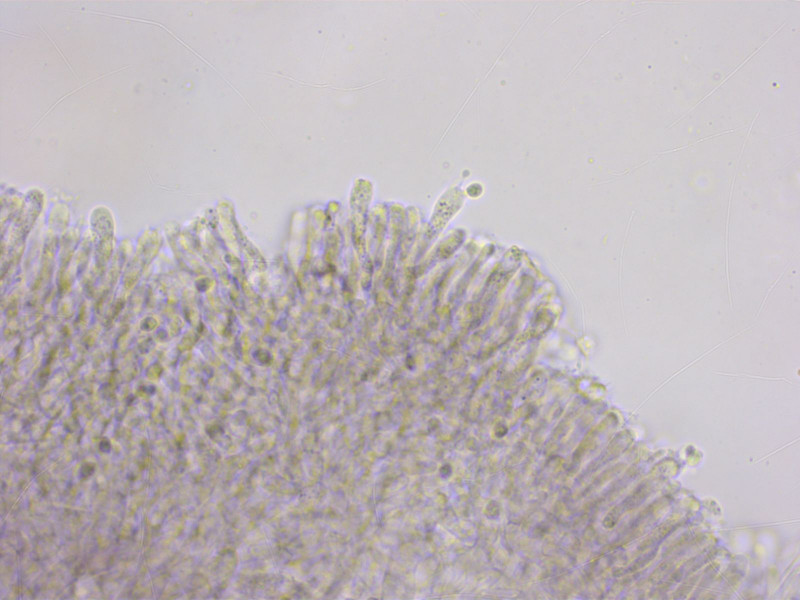
Auch hier meine ich wieder eine siderophile Granulation zu erkennen, aber noch undeutlicher als bei der ersten Kollektion.
Vielleicht interpretiere ich da auch zu viel rein.
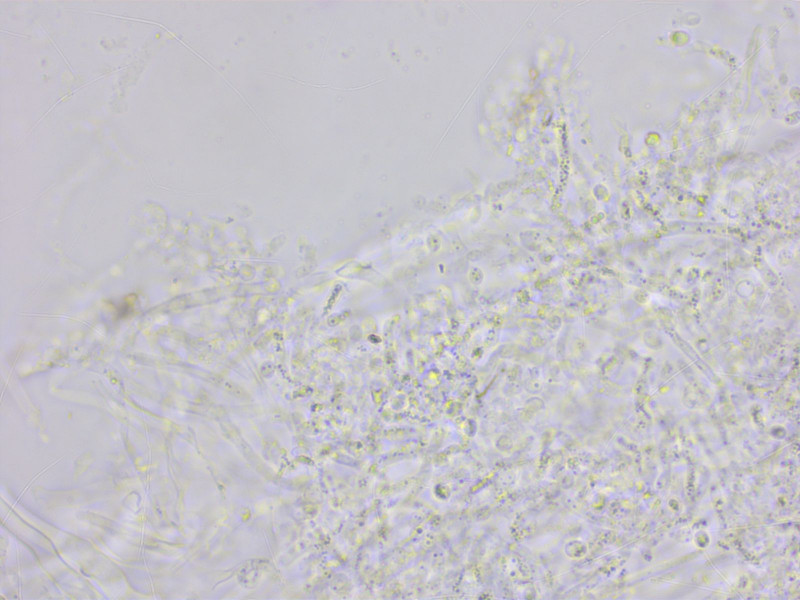
HDS vakuolär pigmentiert. Schnallen überall häufig.
3:

Eine leider schon etwas trockene Gruppe, vielleicht deshalb unbestimmbar.
Hier habe ich wenigstens eine Vermutung: Pseudoomphalina kalchbrenneri.
Typisch ist der flachgedrückte Stiel. Die Schwester-Art Pseudoomphalina compressipes gibt es nach neuen Untersuchungen wohl nur in Nordamerika.
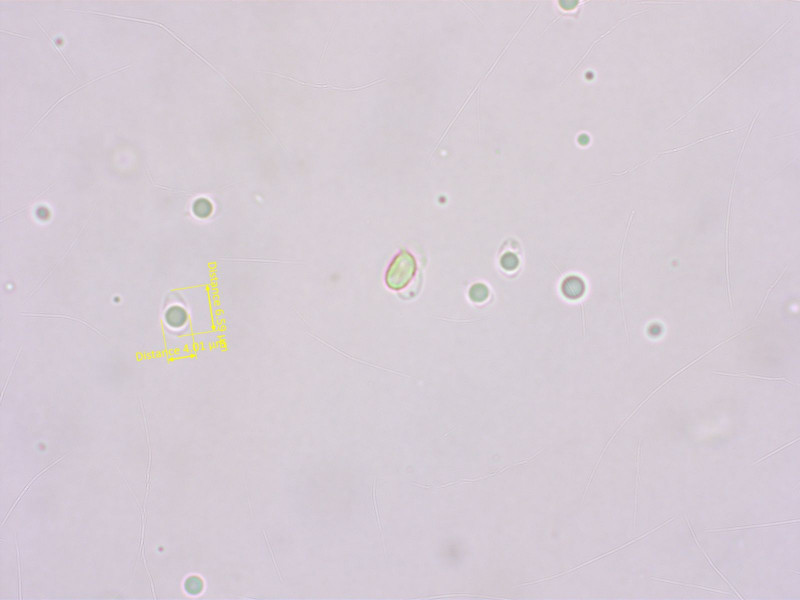
Pseudoomphalina sollte schwach amyloide Sporen haben. Leider war der Sporenabdruck zu dünn für einen Test.
Aber unter dem Mikroskop meine ich in Melzer auch eine schwach amyloide Färbung zu sehen.
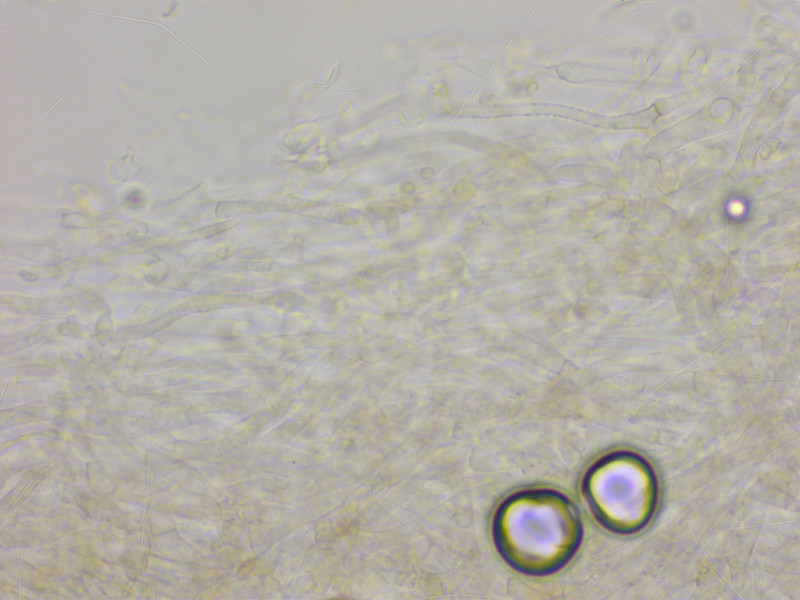
Die HDS zeigt intrazelluläres und teilweise inkrustierendes Pigment. Schnallen überall häufig.
4:

Sieht aus wie Nr. 1, ist aber etwas völlig anderes. Habitat wieder bei Pinus sylvestris, Geruch schwach süsslich.
Was es ist? Nicht die geringste Ahnung.
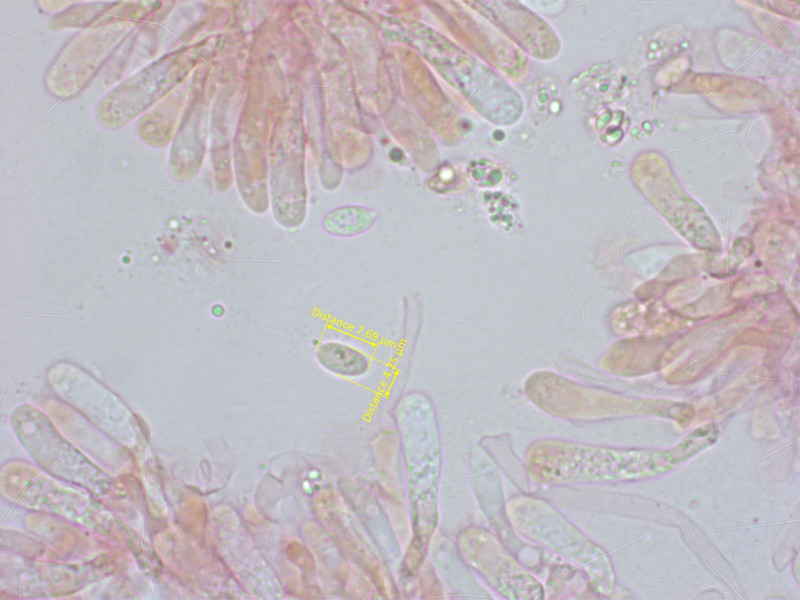
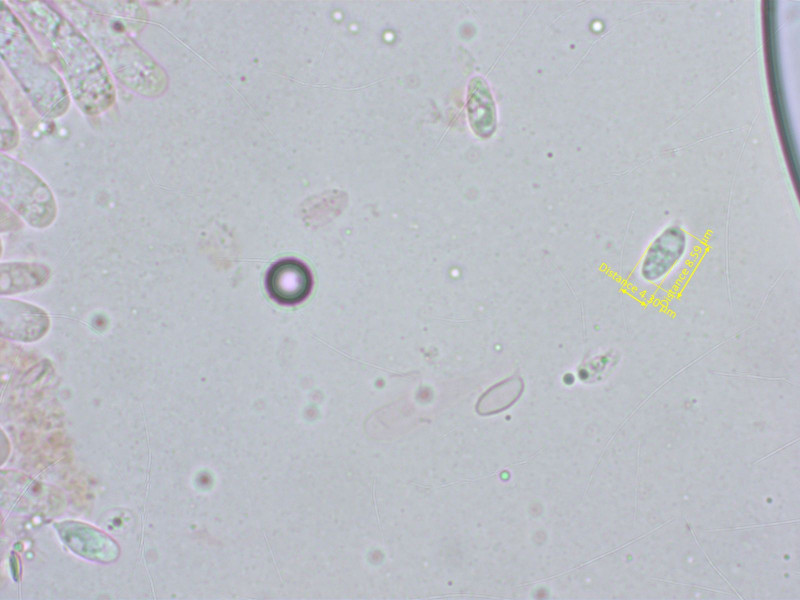
Einen Sporenabdruck gab es nicht. Aber im Präparat fanden sich einige eher schlank elliptische, teilweise auch schwach spindelförmige Sporen.
Und wieder erkennt man stellenweise eine siderophile Granulation.
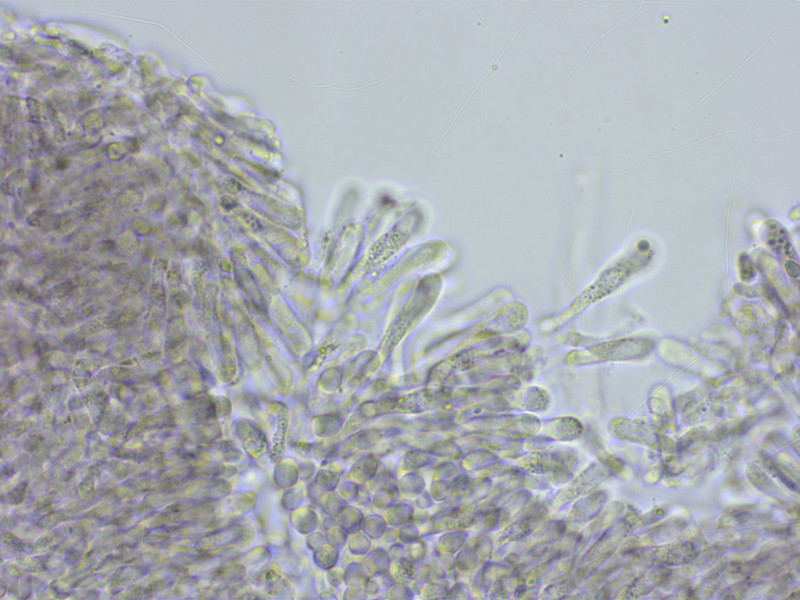
HDS: EIne Ixokutis aus schlanken Hyphen, intrazellulär und inkrustiert pigmentiert. Schnallen überall häufig.
5:

Habitat: Sandiger Trockenrasen mit eingestreuten Kiefern.
Geruch etwas süsslich. Trotz der hellen Farben deutlich hygrophan, zu weiss ausblassend.
Hier komme ich zu keinem besseren Ergebnis als Clitocybe agrestis, bin mir da aber überhaupt nicht sicher.
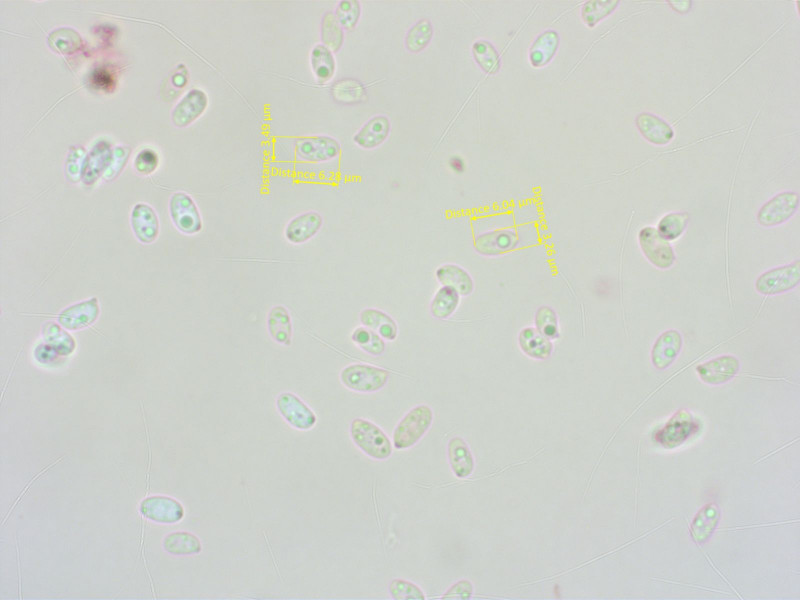
Sporen unspektakulär.

HDS aus hyalinen Hyphen, keine Inkrustationen gefunden. Schnallen vorhanden.
6:

Ein stark hygrophaner Trichterling, zu creme ausblassend. Gleiches Habitat, sandiger Trockenrasen.
Ich halte es für Clitocybe barbularum.

Sporen eher breit elliptisch
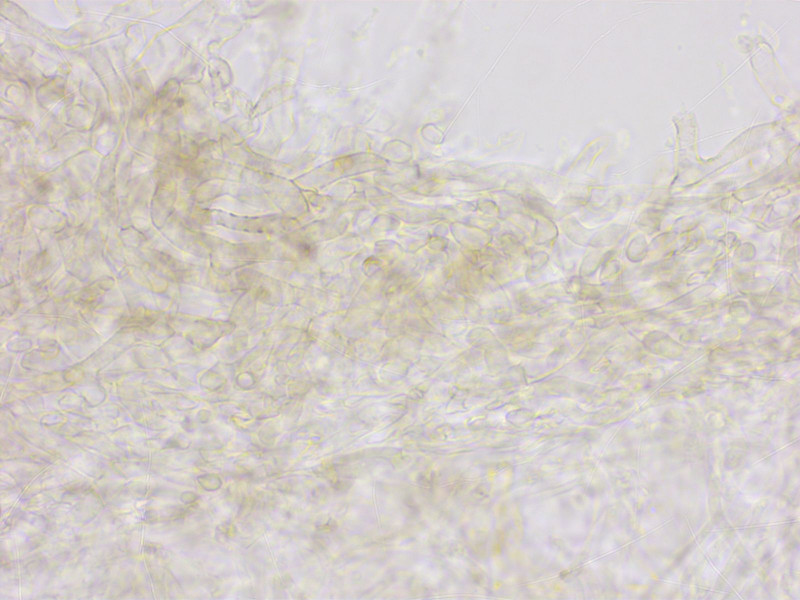
HDS bräunlich pigmentiert, stellenweise inkrustiert.
7:

Ein graufilziger Trichterling. Habitat wie oben (Trockenrasen).
Ich dachte erst es sei Spodocybe collina, davon bin ich aber abgekommen.
Der Stiel hat die gleiche Farbe wie der Hut, bei Sp. collina sollte er fast weiss sein.
Zudem fehlte der typische, starke Mehlgeruch.
Dieser hier war scheinbar geruchlos. Als ich ihn anschnitt gab es für kurze Zeit einen kräftigen, holzartigen Geruch, der aber sofort wieder verschwand.
Ohne Mehlgeruch und mit diesem Habitat bin ich ziemlich aufgeschmissen bei der Bestimmung. Vielleicht Clitocybe parilis ss. Bres.?
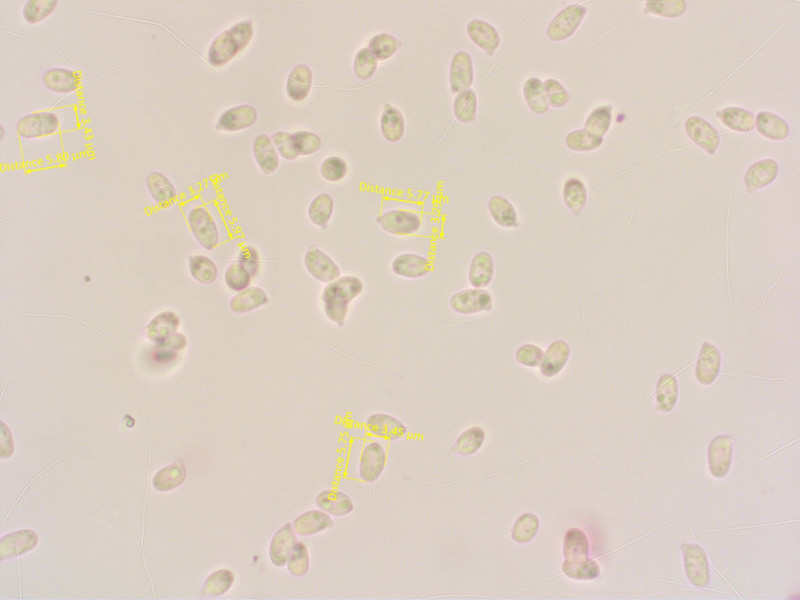
Die Sporen sind auch deutlich grösser als bei den Spodocybe-Kollektionen die ich schon gefunden habe.
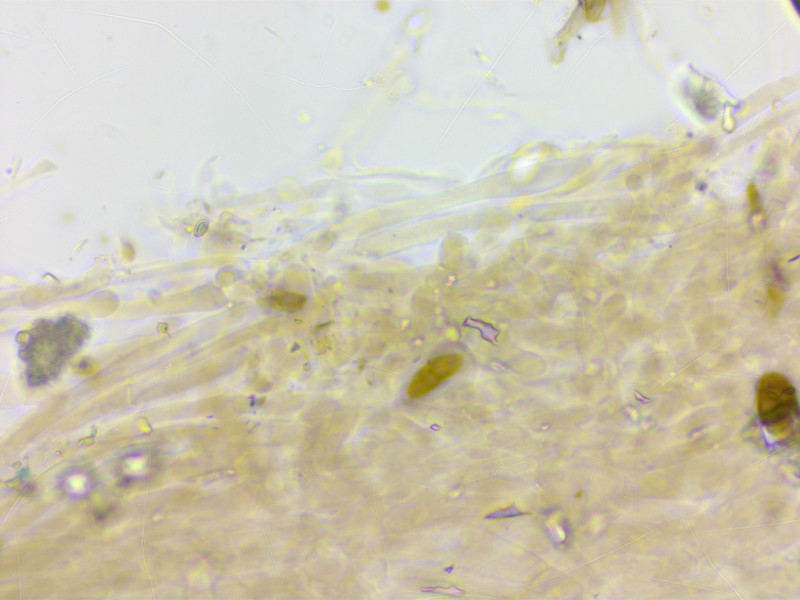
Die HDS ist diffus braun pigmentiert, ohne Inkrustationen.
8:

Ein bereifter Trichterling auf einer Magerwiese.
Ich meine es ist wohl einfach Clitocybe rivulosa.
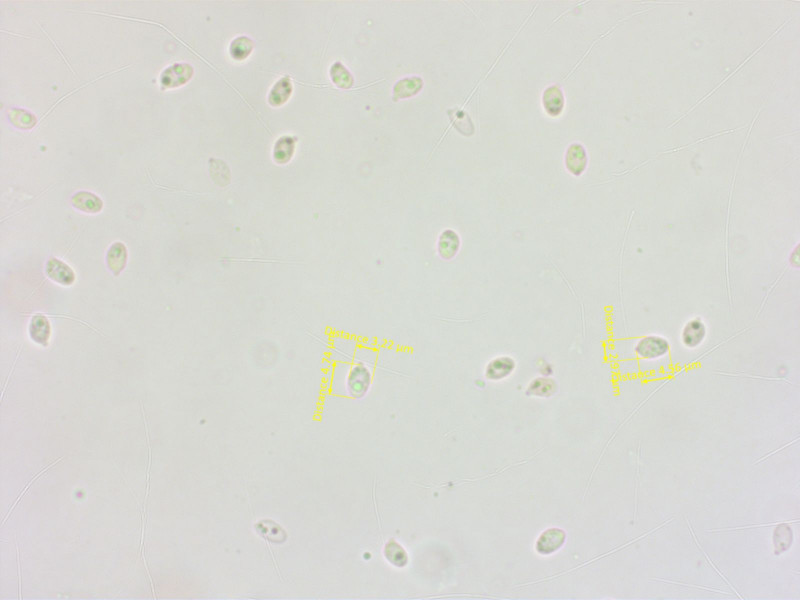
Die Sporen sind allerdings etwas klein geraten.
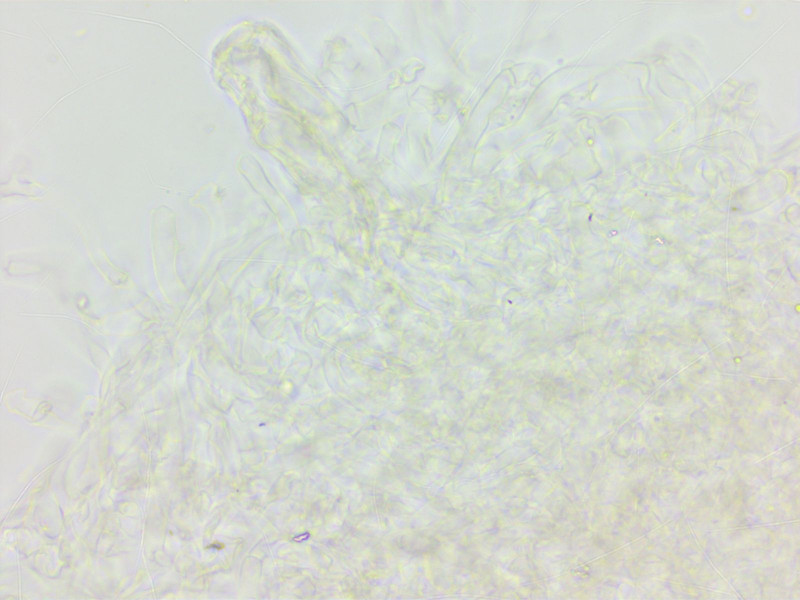
Die HDS war schwierig zu mikroskopischen, das stellenweise vakuoläre Pigment das ich sonst von der Art kenne fand ich nicht.
9:

Wieder vom Trockenrasen. Hut absolut glatt und kahl. Aufgrund von Standort, Habitus etc. ist es wohl Infundibulicybe glareosa.
Geruch süsslich, KOH auf Hut negativ.
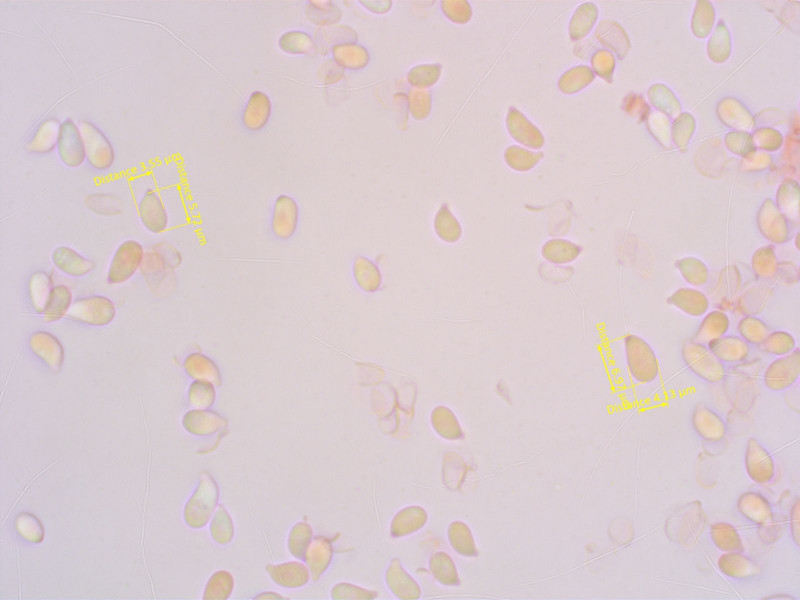
Sporen tropfenförmig
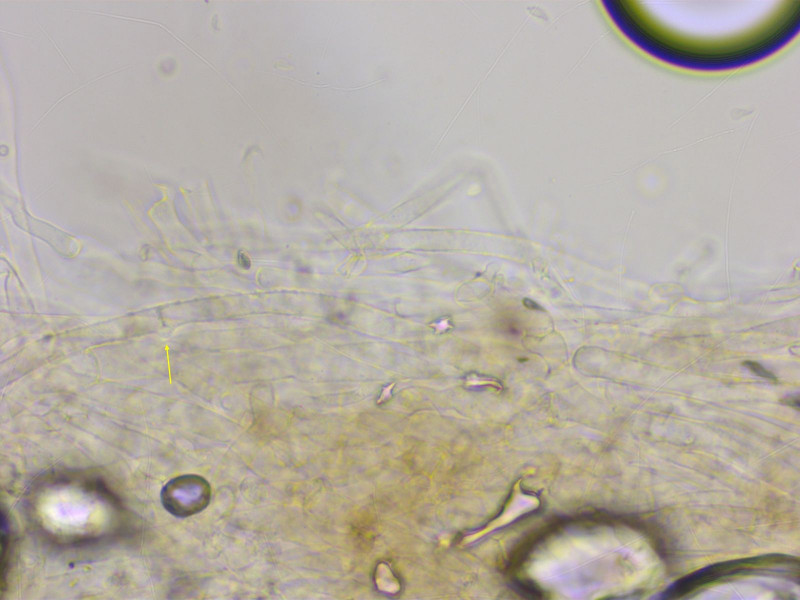
HDS bräunlich pigmentiert und inkrustiert.
10:

Vielleicht die gleiche Art wie Nr. 9? Aber der Hut ist doch deutlich anders gefärbt, und anders strukturiert, deutlich faserig-samtig.
Nr. 9 und 10 wuchsen im gleichen Areal, aber lokal strikt getrennt. Es gab überall kleine Gruppen von Trichterlingen, entweder 9 oder 10, aber nie beides direkt beieinander.
Geruch süsslich, KOH auf Hut negativ.
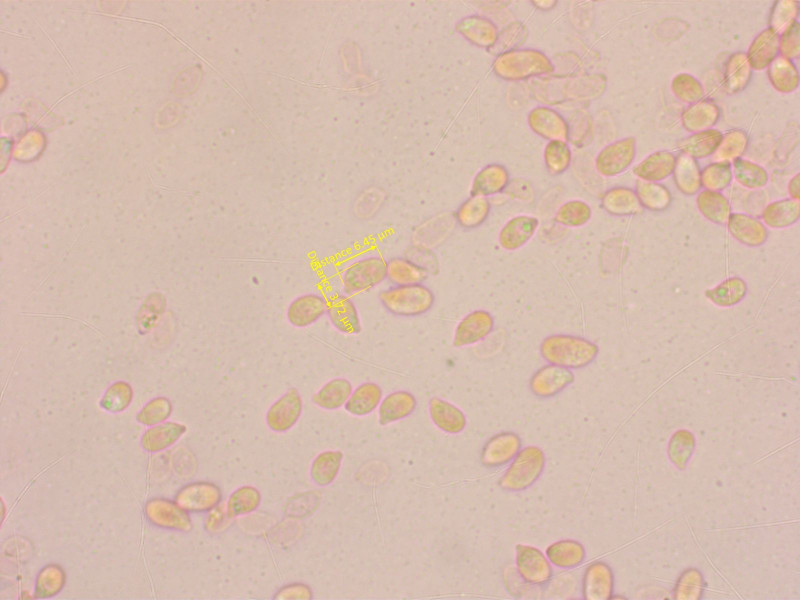
Bei den Sporen erkenne ich keinen Unterschied zwischen 9 und 10.
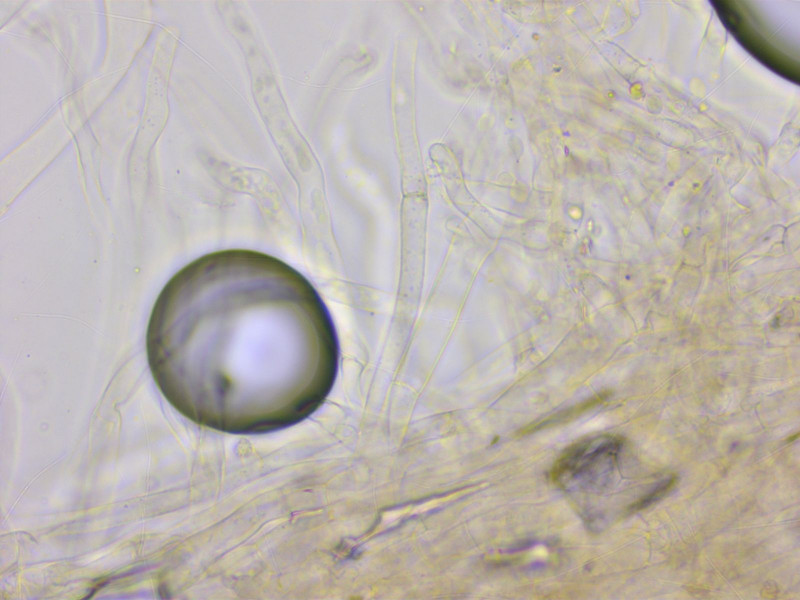
Die HDS ist bei 10 doch etwas anders, die Inkrustationen sind seltener und feiner, oft nur wie punktiert. Und es gibt mehr aufsteigende Hyphen.
So, das war's. Ich freue mich auf üppiges Feedback 
Gruss Raphael


