Hallo zusammen
Gestern habe ich mir einen freien Tag gegönnt und war in den Bergen. Ziel war die Turtmannspitze, ein unbedeutender Gipfel in der Nähe. Und natürlich die Pilze auf dem Weg dorthin.
Nach wie vor sind die Wälder pilzleer, erst ab 2400m gibt es etwas. Somit müsst ihr euch mit einem weiteren alpinen Beitrag abfinden.
Achtung, wer kein Interesse an Omphalina's hat, sollte lieber nicht weiterlesen. Ich kam mit sechs Nabelings-Kollektionen heim und bin beim Bestimmen fast verzweifelt.
Die meisten Namen unten sind mit ziemlicher Ungewissheit verbunden, bitte korrigiert mich wenn ihr bessere Vorschläge habt.
1: Bovista paludosa

Dieser Bovist wuchs in grosser Zahl in einem Sumpf auf 2400m.

Capillitium dickwandig, nach Jeppson vom "Bovista-Typ".
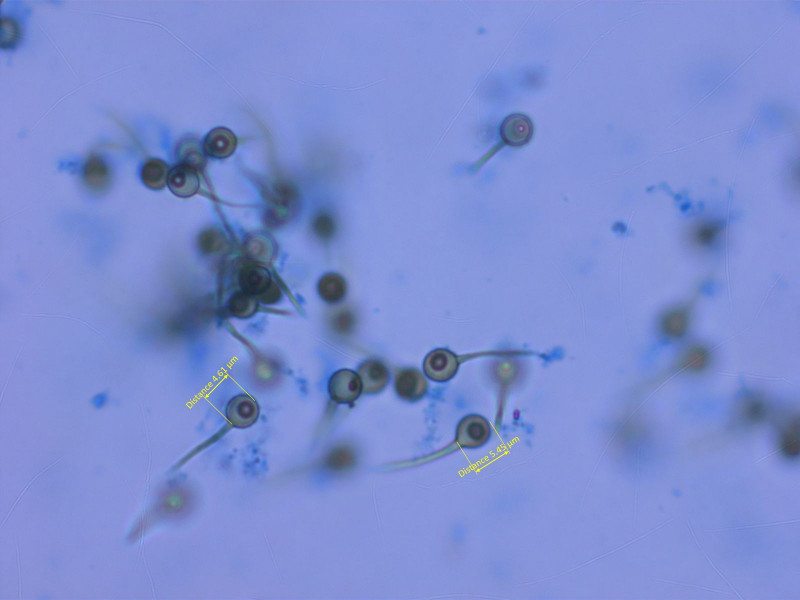
Sporen mit langem Pedicell, sehr fein warzig, was man auf dem Bild kaum sieht.
2: Ein Rötling... Entoloma conferendum

Diese braunen Rötlinge sind normalerweise eine ziemlich Herausforderung...

... aber wenn man diese Sporen sieht, ist die Arbeit getan.
3: Cortinarius aff. oreobius (ss. Breitenbach&Kränzlin)

Alpine Telamonien sind der Horror... auch hier komme ich zu keiner plausiblen Bestimmung, immer stimmt irgendwas nicht.
Insgesamt passt mir C. oreobius am besten, allerdings nur die Darstellung bei PdS.
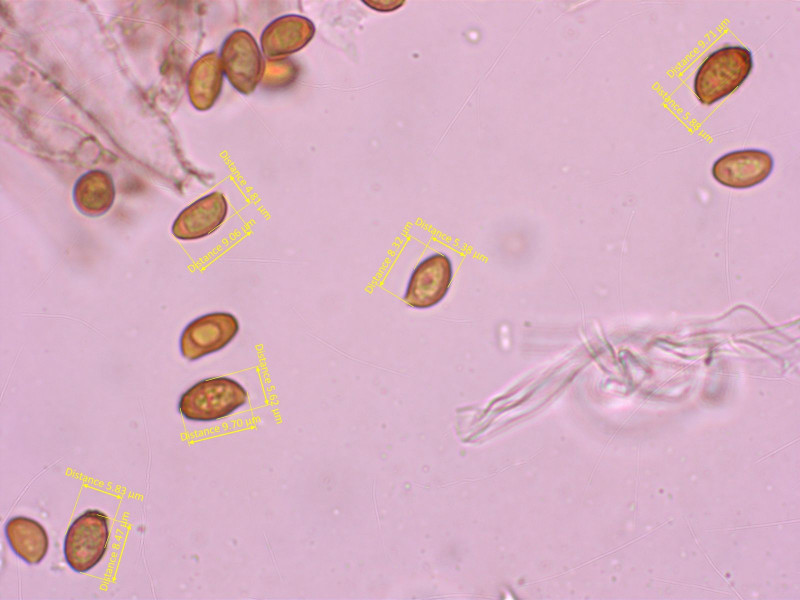
Sporen moderat warzig, basal deutlicher, selten länger als 10 µm.
Damit passt es nicht ganz zur Original-Beschreibung von Favre und dem Portrait im AdC, wo die Sporen etwas grösser sind.

Schneide unter der Lupe weiss bewimpert, im Mikroskop findet man dann viele lange, zylindrische Marginalzellen.
Die sind das Hauptproblem, alle anderen Kandidaten müssten kurze, keuligen Marginalzellen haben.
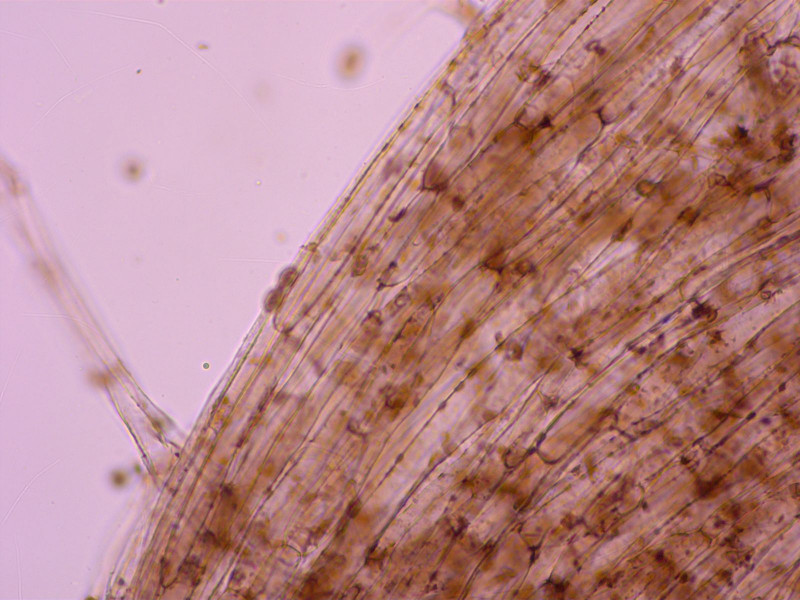
Stielhyphen kräftig inkrustiert.
4: Panaeolus papilionaceus

Wenigstens mal ein alltäglicher Pilz...
5: "Omphalina 1":

Habitat: An einer Quelle auf 2550m im bzw. am Moos.
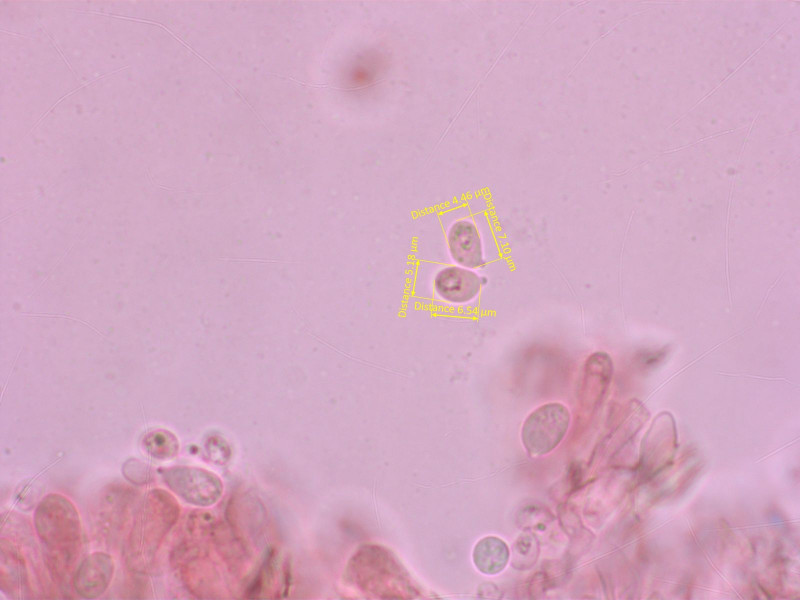
Sporen ziemlich breit und eher klein, weniger über 8 µm. Basidien 4-sporig, keine Zystiden.

HDS etwas gelifiziert, hyalin, weiter unten inkrustiert. Schnallen vorhanden.
Hier komme ich nach Gröger auf Arrhenia onisca. Mich stört aber diese grobe Riefung der Hüte, nach Ludwig etc. sollte die viel feiner sein.
6: "Omphalina" 2:

Die wuchs an einer sehr nassen Stelle im Sumpf, aber eindeutig terrestrisch, nicht an Moos.

Die Sporen sind - je nachdem wie sie liegen - apikal deutlich verjüngt, so dass die Sporen leicht spindelig-rautenförmig sind.
Basidien 4-sporig, keine Zystiden.

Nur die oberste Schicht der HDS ist hyalin, darunter fein inkrustiert. Schnallen vorhanden.
Hier komme ich nach Gröger und FN - mit einigen Fragenzeichen - auf Omphalina arctica.
O. pyxidata hätte ähnliche, aber etwas kleinere Sporen, und passt aber auch vom Standort her nicht.
7: "Omphalina" 3:

Ganz ehrlich, keine Ahnung was das ist. Vielleicht gar keine Omphalina? Durchmesser bis 5mm.
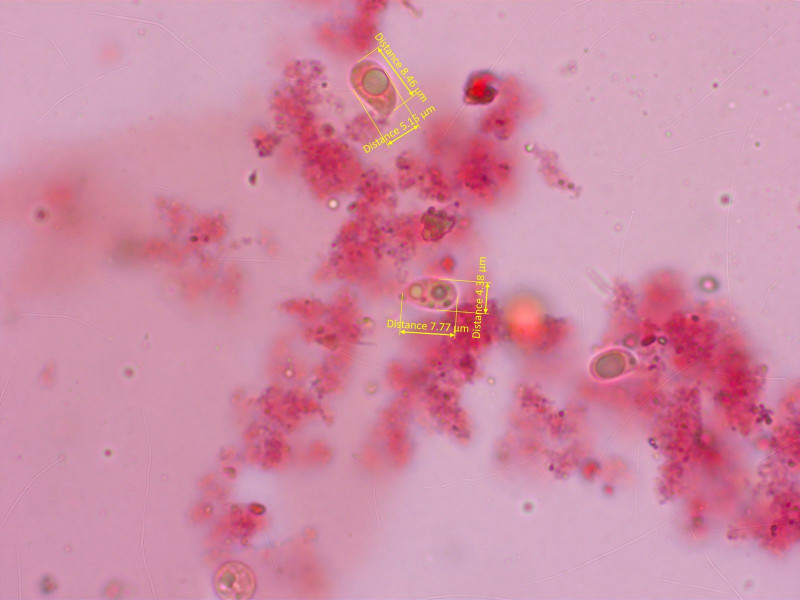
Auf jeden Fall hat das Pilzchen Sporen, die von der Form her zu Omphalina passen würden.

Basidien rein 1- oder 2-sporig, ich konnte trotz intensiver Suche keine 4-sporige Basidie finden.

HDS aus glatten, teils etwas aufsteigenden Hyphen. Zystiden gab es nirgends.
Nach Gröger komme ich auf Ludwig's Omphalina albominutella. Aber die ist 4-sporig und passt auch makroskopisch nicht.
Hat jemand einen anderen Tipp für mich?
8: "Omphalina" 4:

Die hier wuchs im Moos (nicht speziell nass) am Bachufer.
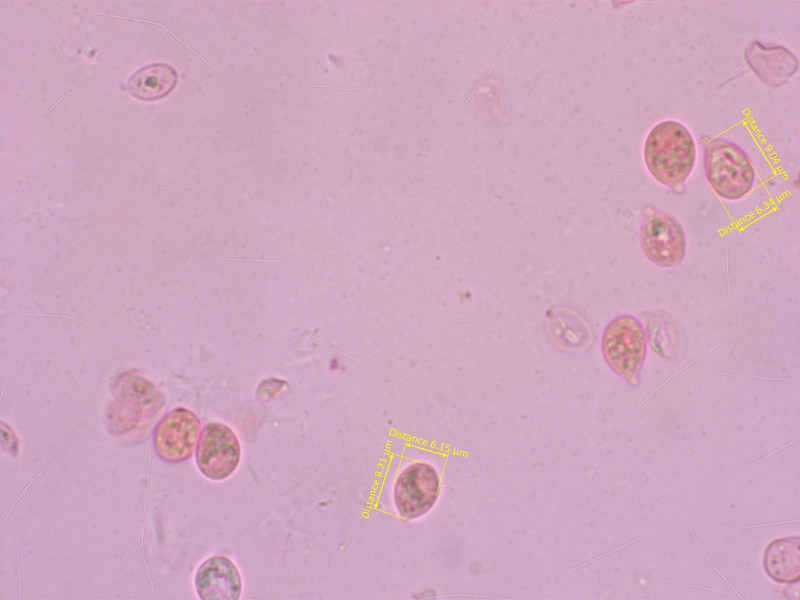
Sporen wieder recht breit. Basidien 4-sporig, keine Zystiden.

HDS wieder hyalin, weiter unten inkrustiert, mit Schnallen.
Nach Gröger kommt dieses Mal Omphalina rivulicola raus. Kann stimmen oder auch nicht, je nachdem wem man glaubt wie stark der Hut gerieft sein darf.
Omphalina pyxidata kommt wegen der Sporenform nicht in Frage.
9: "Omphalina" 5:

Die ist wenigstens einfach...
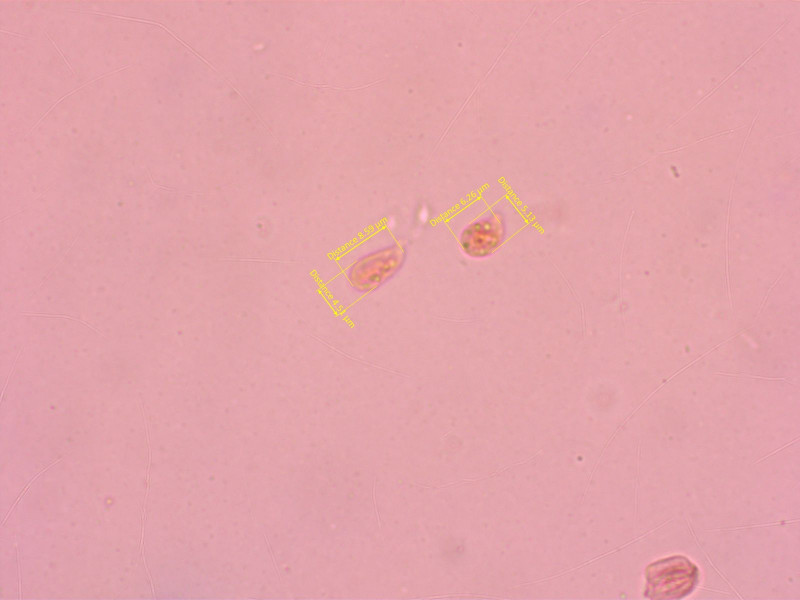
Sporen tropfenförmig, oft recht schlank. Basidien 4-sporig.

HDS kräftig inkrustiert, Schnallen vorhanden.
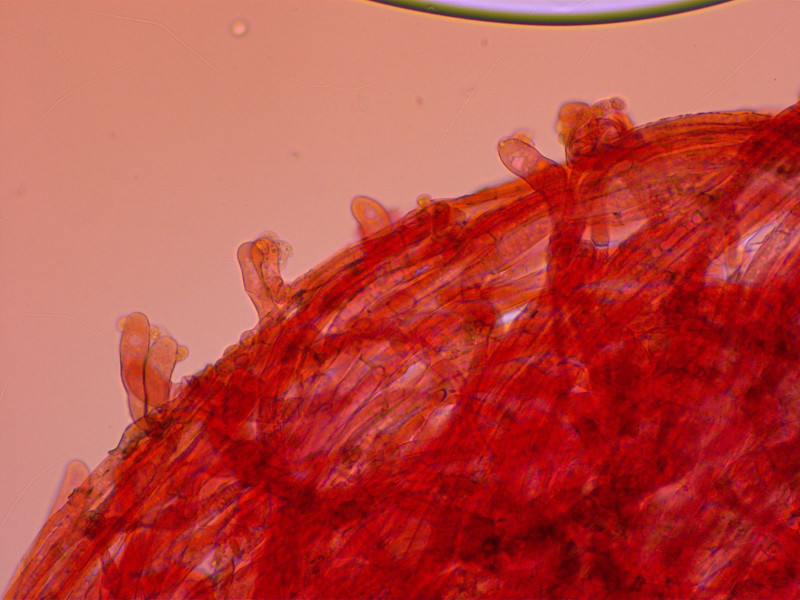
Stiel mit zahlreichen Kaulozystiden.
Damit sollte es Arrhenia velutipes sein.
10: "Omphalina" 6:

Das hier ist das trostlose Habitat dieses Pilzes: In einem ausgetrockneten See auf 2950m, direkt unter dem angepeilten Gipfel.
Es gefiel ihm offenbar sehr gut dort, er wuchs zu Hunderten im nackten Sand.

Bis 7mm im Durchmesser, Hut dunkel graubraun, Stiel noch etwas dunkler.

Die Sporen helfen nicht wirklich weiter. Basidien 4-sporig.

HDS schon wieder oben hyalin, darunter inkrustiert. Schnallen gab es auch.

Erst als ich die Fruchtkörper zum Trocknen von dem vielen Sand befreite, fiel mit etwas auf: Die haben alle an der Basis so eine Art Sklerotium.


Wenn man dieses "Sklerotium" unters Mikroskop wirft, kommen solche grünen Strukturen zum Vorschein.
Ich vermute, die Art ist lichenisiert. Aber was weiss ich schon...
Kurzum: Nach Gröger und FN kann es fast nur Arrhenia rigidipes sein. Leider wieder so eine Art, von der es nur eine Original-Beschreibung keine glaubhaften Bilder gibt.

Am Ziel der Wanderung...
Viele Grüsse
Raphael


