Hallo zusammen
Heute hatte ich endlich mal wieder Zeit für eine längere Exkursion. Ich ging ohne viel Hoffnung los, denn die Trockenheit hat die Gegend hier fest im Griff.
Die gelegentlichen kurzen Gewitter ändern daran nichts. Start war in dem kleinen Dorf St-Luc.
Die Fichtenwälder, Lärchenwälder und subalpinen Weiden waren absolut pilzleer. Es gab nicht einmal vertrocknete Täublingsleichen.
Und das obwohl ich extra durch eine schattige Schlucht mit viel Wasser aufstieg (kein Sorge, da gibt es einen Wanderweg):

Aber dann, nach zwei Stunden auf 2400m, kam ich ins Paradies. Plötzlich waren die Pilze einstimmig der Meinung, dass ihnen die Bedingungen gefallen.
Ok, ich musste den kleinen Wasserläufen folgen, abseits davon war auch nichts.

Hier gibt es zum Glück noch frei fliessendes Wasser, wo der Mensch nicht alles besser weiss und meint er müsse für Ordnung in der Natur sorgen.
Was es hier so an Pilzen gab:
1:
Ein Ackerling, der in einer sumpfigen Wiese in grosser Zahl wuchs.

Beringt, schlanker Wuchs, hygrophan.
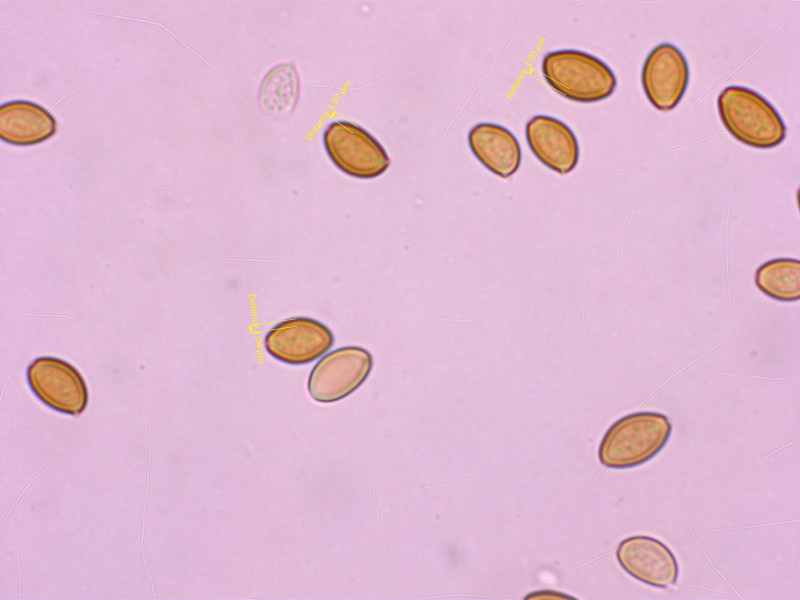
Sporen deutlich dickwandig, Wände um 1 µm.
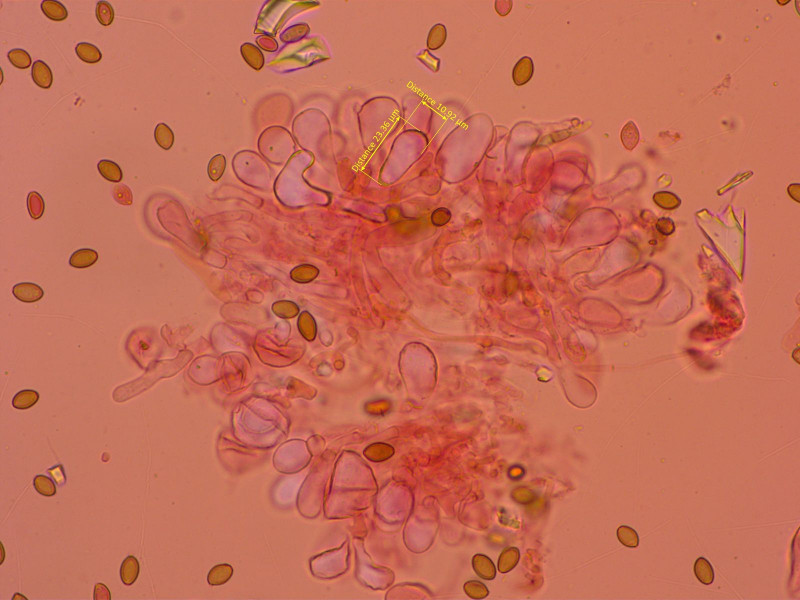
Recht kleine, keulige Cheilozystiden, Schneide steril.

Einzelne, grössere, bauchige Pleurozystiden.
In Summe spricht das für Agrocybe elatella.
2: Ein einfacher Bestimmling.

Arrhenia lobata, die sich im nassen Moos am Wasser extrem wohlfühlte und dies durch ein Massenvorkommen kundtat.

Blick auf die Sporen... Schnallen waren übrigens vorhanden.
3: Ein naher Verwandter von 2, auch wenn er nicht danach aussieht:

Kleine braune, nabelingsartige Pilzchen in einer feuchten Wiese mit Zwergweiden.

Die Sporen sind verschieden geformt. Teils elliptisch, etwas tropfenförmig, ...

... oder sogar birnenförmig.
Damit sollte das Arrhenia obscurata sein.
Nein ist es nicht, es ist Omphalina chionophila.
4:
Den hätte ich eigentlich nicht mitnehmen sollen, nur ein brauchbarer Fruchtkörper, der andere ist eine Mumie.

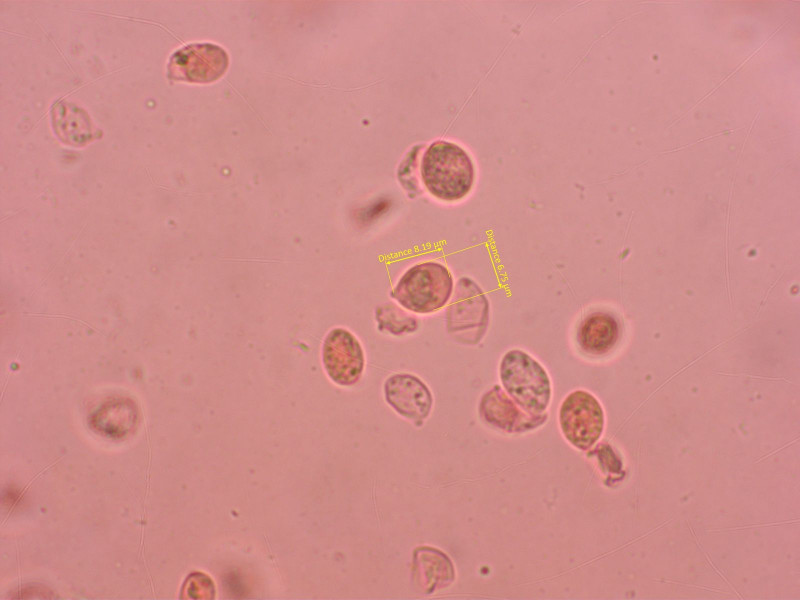
Sporen eher breit elliptisch.
Eine belastbare Bestimmung ist das nicht, ich halte es für Omphalina rivulicola oder Omphalina pyxidata.
5: Den kennt ihr alle, hier oben gibt es ihn auch.

Gymnopus dryophilus
6: Ein winziger Saftling. Bis 5mm im Durchmesser mit feinschuppigem Hut.


Sporen bis deutlich über 11 µm lang, gleichmässig geformt, nicht eingeschnürt.
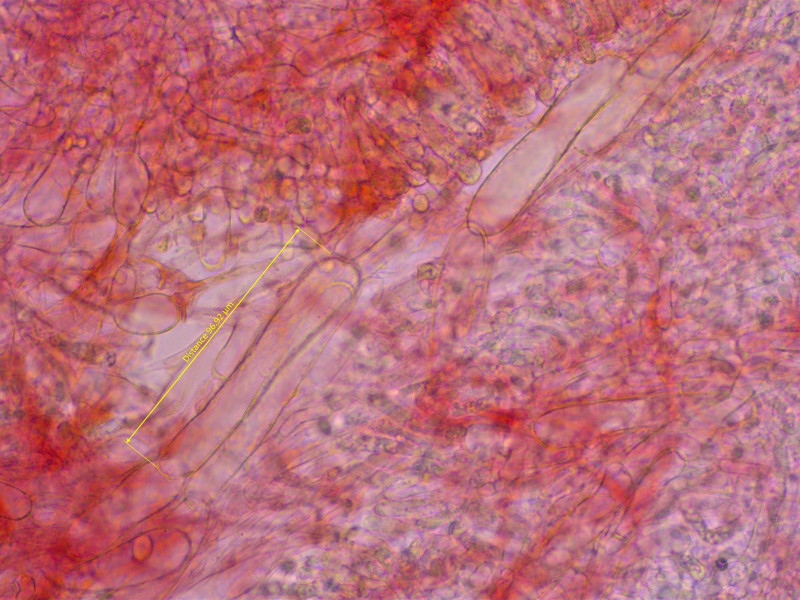
Lamellentrama aus recht kurzen Elementen.

Stipititrama mehrheitlich aus recht kurzen Hyphen, das soll wohl wichtig sein bei dieser Gruppe.
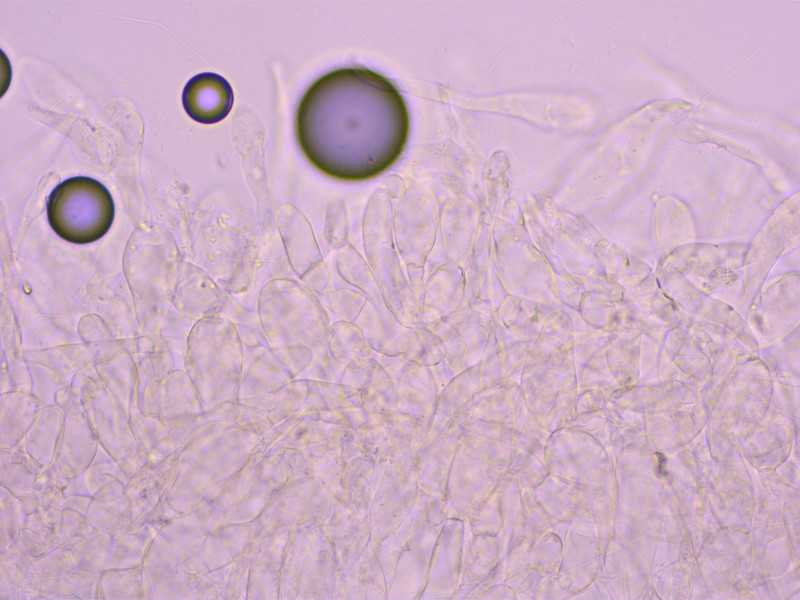
HDS trichodermal, vor allem zur Hutmitte. Am Rand eher ein Übergang zu einer Kutis.
Die Mikromerkmale sprechen für Hygrocybe glacialis. Allerdings sind die Unterschiede zu H. calciphila sehr fein.
Die Bodenart hilft mir leider nicht weiter, die Zusammensetzung des Bodens ändert sich dort alle paar Schritte.
7: Ein Milchling mit violett verfärbender Milch.

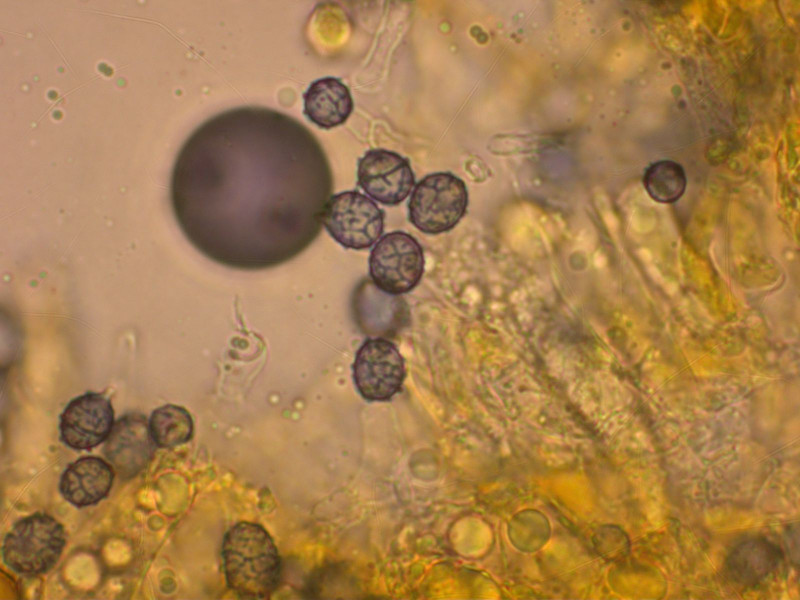
Die Sporen sind netzig und selten länger als 9 µm.
Damit sollte das wohl Lactarius pseudouvidus sein.
8: Ein Täubling, nicht selten, aber schön anzuschauen:

Spp weiss, Geschmack sehr scharf.
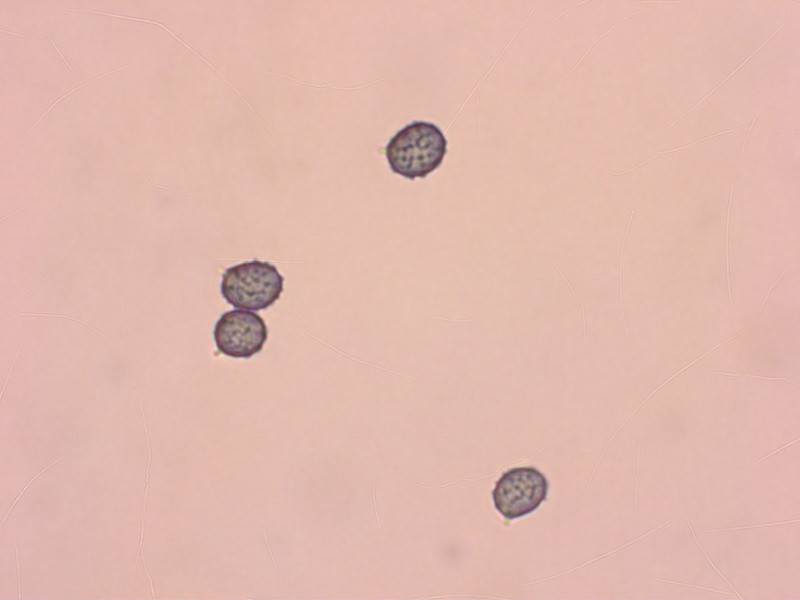
Sporen warzig mit sehr feinen Verbindungen, 8-9 µm lang.
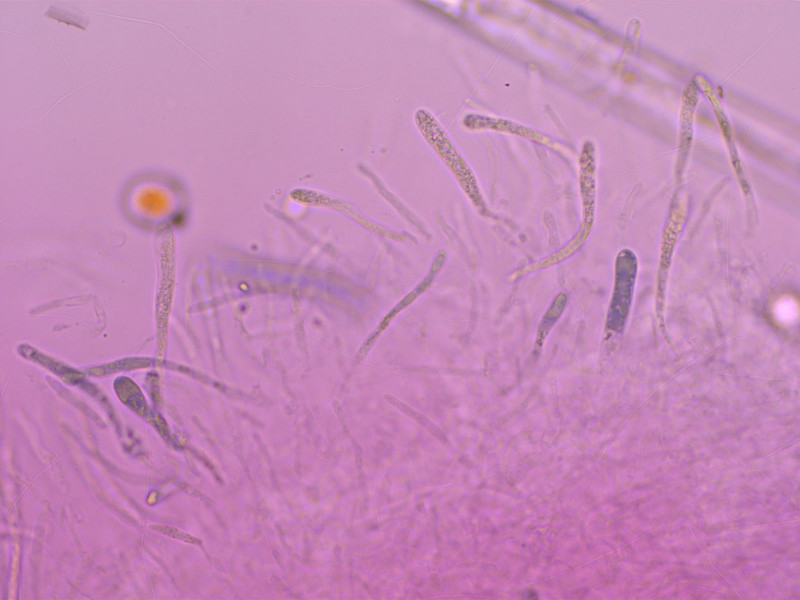
Pileozystiden in SV.
Schon makroskopisch kommt man wohl an Russula nana nicht vorbei.

Alles in allem doch ein lohnender Tag.
Viele Grüsse
Raphael


