Hallo zusammen
Hier ist die Pilzsaison so ziemlich vorbei ist (morgen gibt es Frost und Schnee).
Also habe ich wieder Zeit, ein paar Funde ins Forum zu stellen.
Wichtig an alle, die Fälblinge hassen oder oder langweilig finden: Bitte ganz schnell den Thread schliessen und nie wieder öffnen.
Die Fälblings-Bestimmung ist ja nie ganz einfach, wenn ich irgendwo falsch liege und das jemand eine bessere Idee hat, bitte melden.
1:
Der hat mich ziemlich lange beschäftigt und ich bin nicht wirklich sicher dass meine Bestimmung stimmt.

Habitat: Thermophiler Kiefernwald
Geruch schwach rettichartig. L = ca. 70
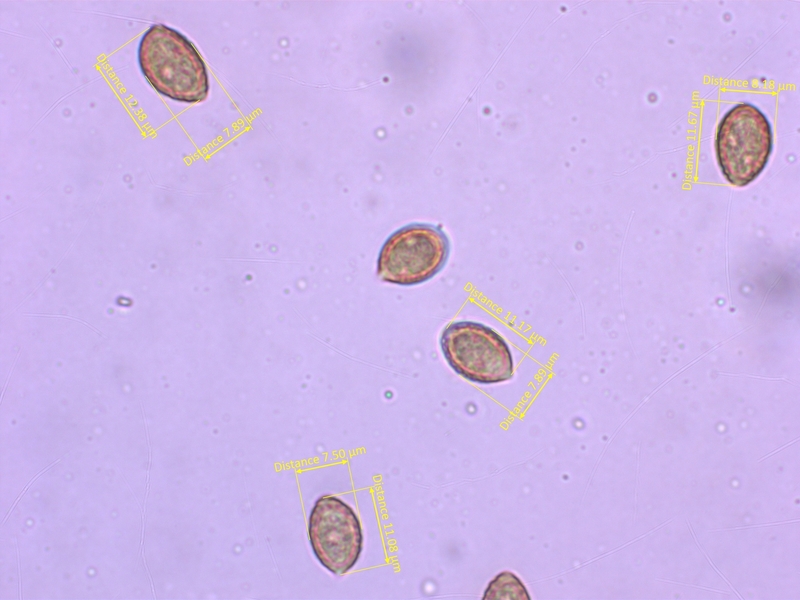
Die Sporen sind recht breit und sehr stark ornamentiert, meistens mit deutlich ablösendem Perispor (O4, P2-3).
Abmessungen etwa 10-12.5 x 6.3-8.2 µm, Q=1.4-1.7
Zudem sind sie sehr stark dextrinoid. (D4)
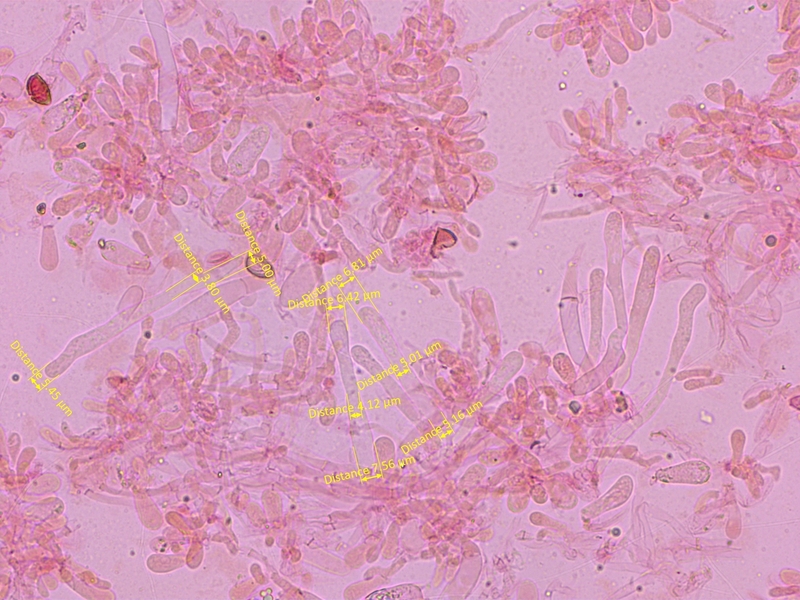
Die Cheilozystiden sind gestielt-keulig.
Mittelwerte (n=10): A=6.45, M=4.36, B=6.73, A/M=1.5, A/B=0.98, B/M = 1.56
Nach langem Hin und Her meine ich, dass es mit diesen stark dextrinoiden, ornamentierten Sporen mit ablösendem Persipor nur Hebeloma echinosporum sein kann.
Gemäss dem Schlüssel in FE14 müsste zwar es H. rostratum sein, aber da fehlen die geschnäbelten Cheilo-Zystiden.
Nur die Zystiden sind schmaler als beschrieben, allerdings basiert die Beschreibung nur auf einer Kollektion.
[trennlinie][/trennlinie]
2:

Habitat: Mischwald bei Fichten.
Geruch kräftig nach Rettich. L=50-60.
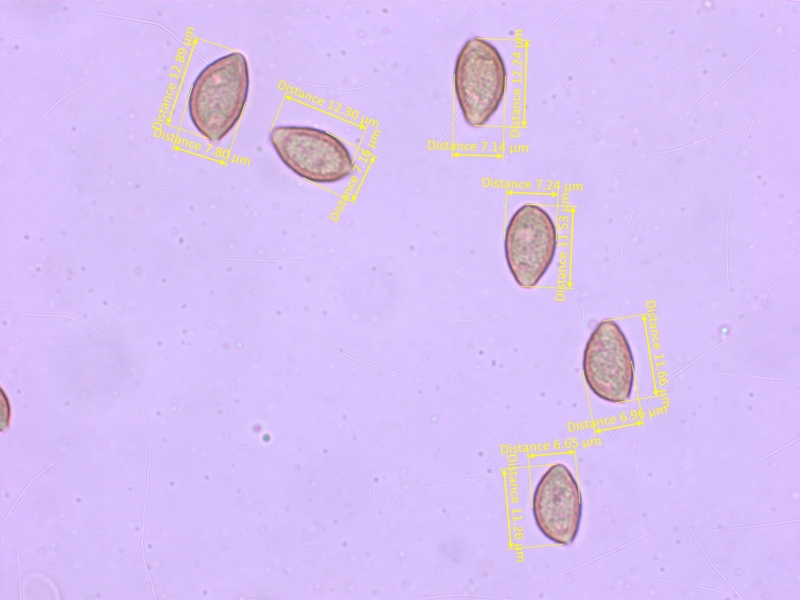
Sporen mässig ornamentiert, ohne ablösenden Perispor, 11.3-13.8 x 6.7-7.9 µm, Q = 1.6-1.95 (O1-2, P0)
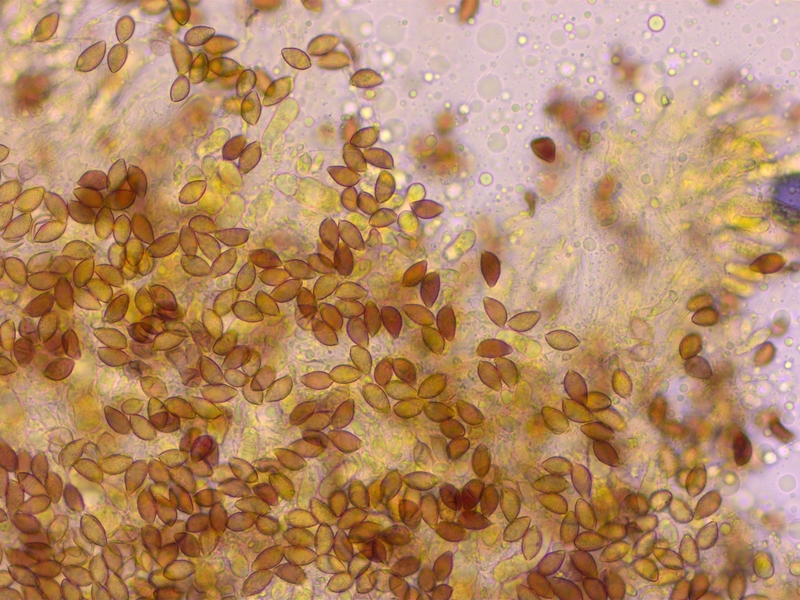
Sporen nur dextrinoid (D2)
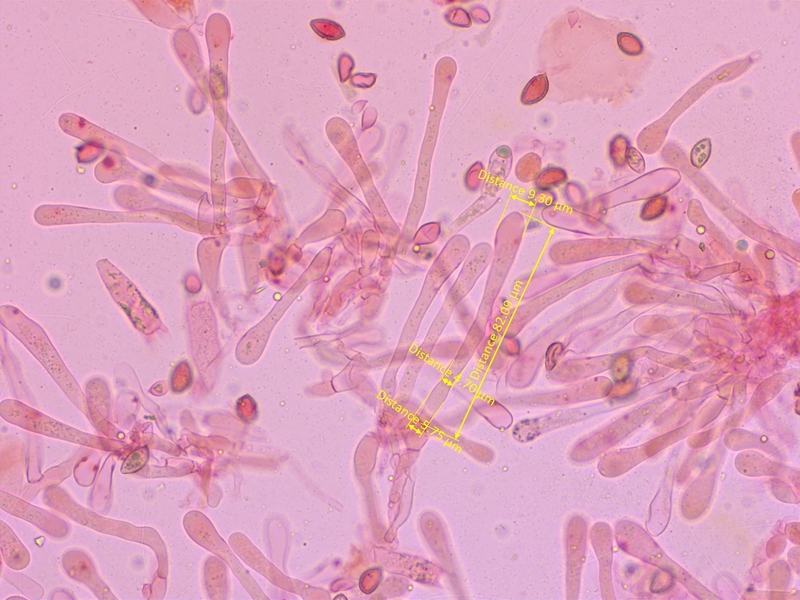
Cheilozystiden gestielt-keulig, mit deutlich verdicktem Apex.
Mittelwerte (n=10): A=8.89, M=4.39, B=5.26, A/M=2.03, A/B=1.71, B/M=1.21
Habitus und Zystiden führen direkt zu dem crustiliniforme-Komplex. Aufgrund des breiten Zystiden-Apex sollte es Hebeloma eburneum sein.
[trennlinie][/trennlinie]
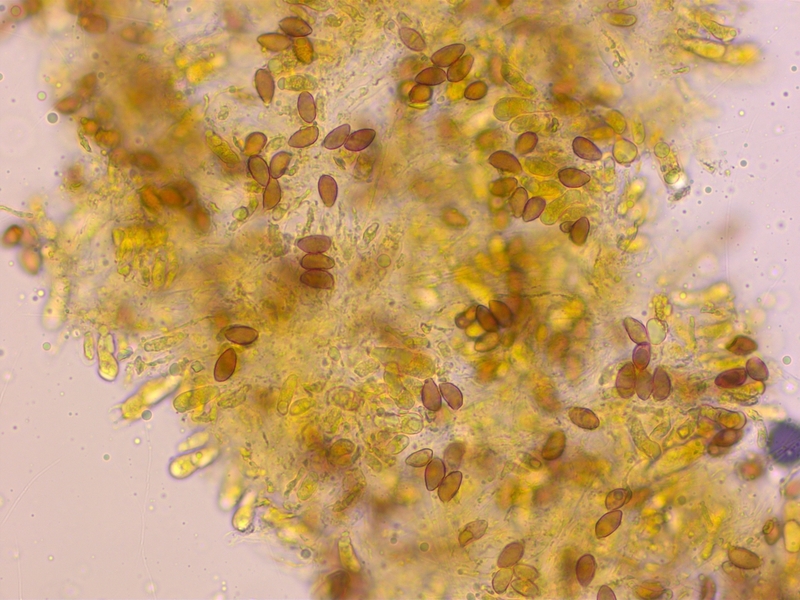
3:

Ganz ehrlich, die hier sehen eigentlich fast gleich aus.
Sie wuchsen unter Erlen in einem Mischwald, wo es sonst vor allem Kiefern und Fichten gab.
Geruch nach Rettich, L= 60-70
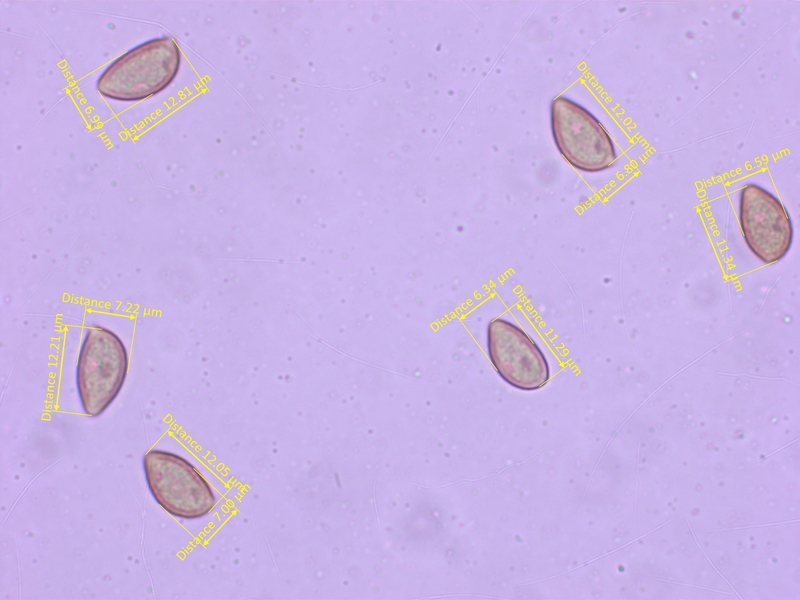
Die Sporen sind kaum ornamentiert, 11-14 x 6.2-7.4 µm, Q = 1.65-2.1 (O1, P0)
Jod-Reaktion schwach (D1-2)
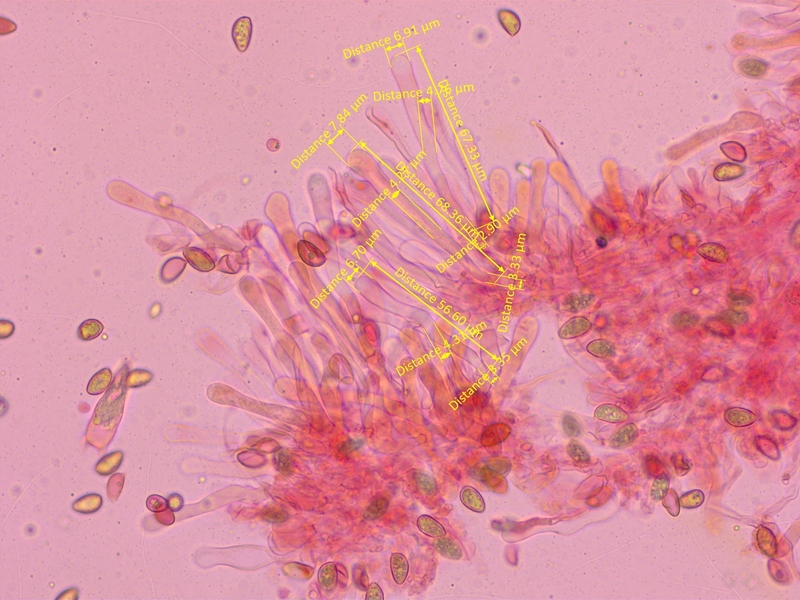
Cheilozystiden gestielt-keulig, aber Apex weniger dick als bei Kollektion 2.
Mittelwerte: L=60, A=7.33, M=4.62, B=3.52, A/M=1.59, A/B=2.12, B/M=0.77
Aufgrund der schmaleren Zystiden sollte das nun Hebeloma crustiliniforme s.str. sein.
[trennlinie][/trennlinie]
4:

Habitat: Mischwald bei Kiefern und Fichten
Geruch schwach pilzig mit Rettichkomponente
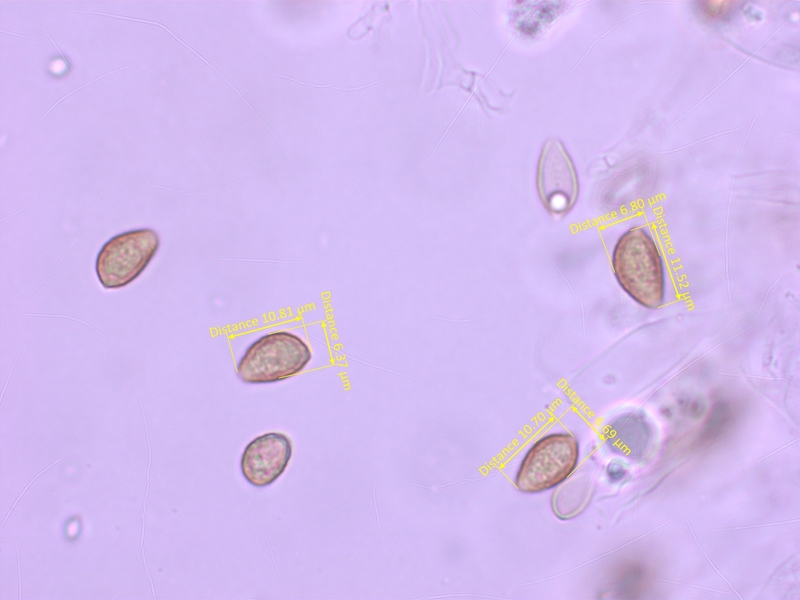
Sporen schwach ornamentiert, ohne ablösenden Perispor (O1-2-3, P0), 10-12 x 5.5-7 µm, Q = 1.55-1.85
Schwach dextrinoid (D2-3)
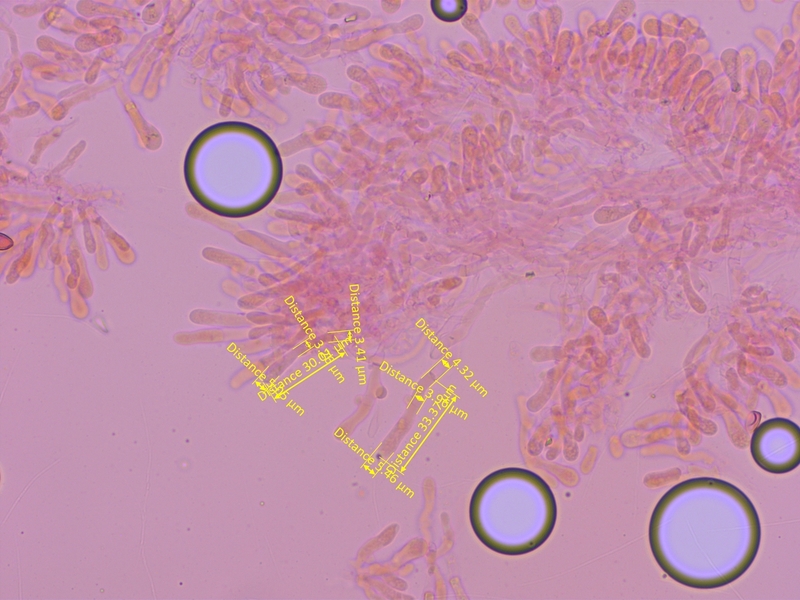
Cheilozystiden kurz keulig bis subzylindrisch, nicht bauchig.
Mittelwerte (n=5): L= 33, A=5.35, M=4.15, B=4.22, A/M=1.30, A/B=1.28, B/M=1.02
Hier habe ich mich beim Schlüsseln vertan und bei einer falschen Schlüsselziffer weitergemacht.
Matthias war so aufmerksam das zu entdecken.
Es ist nicht wie zuerst angenommen Hebeloma incarnatulum, sondern Hebeloma laterinum.
[trennlinie][/trennlinie]
5:

Eine kräftige, grosse Art und dichten Lamellen. Geruch sehr stark nach Rettich.
Habitat im Mischwald bei Fichten, Kiefern und Birken. L=80-85.
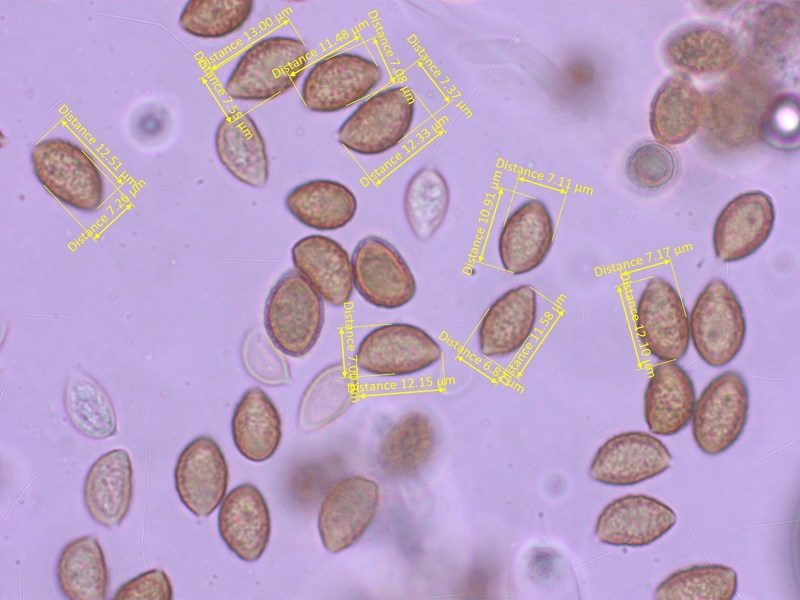
Sporen deutlich ornamentiert, mit teils ablösendem Perispor, 10-13 x 6.5-7.5 µm, Q = 1.5-1.85 (O2-3, P1-2)
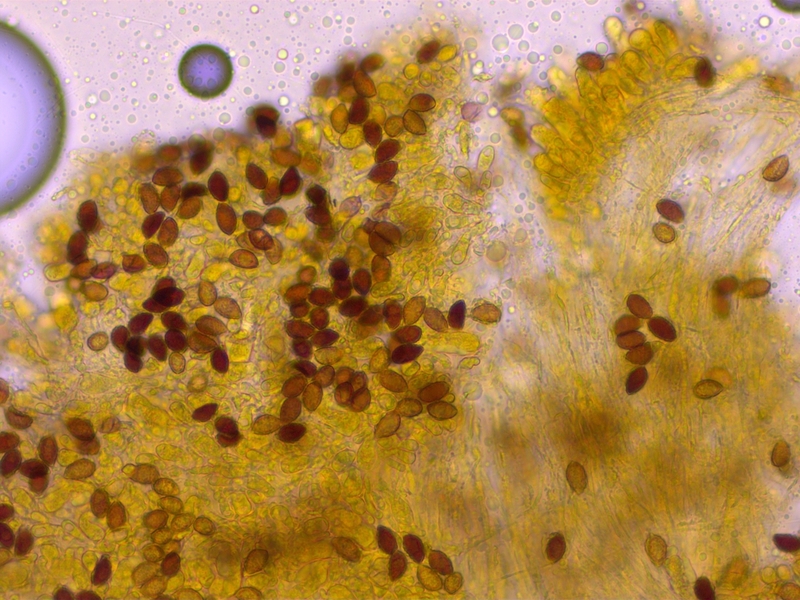
Sehr stark dextrinoid (D3-4)
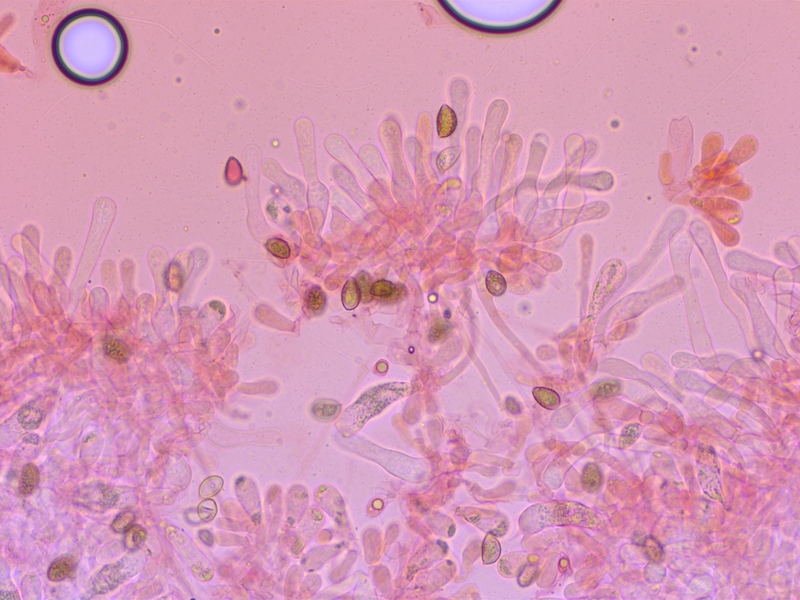
Cheilozystiden keulig-bauchig.
Mittelwerte (n=6): L=39, A=6.77, M=4.68, B=7.36, A/M=1.46, A/B=0.95, B/M=1.59
Mit den sehr dichten Lamellen und den mikroskopischen Merkmalen sollte das Hebeloma sinapizans sein.
[trennlinie][/trennlinie]
6:

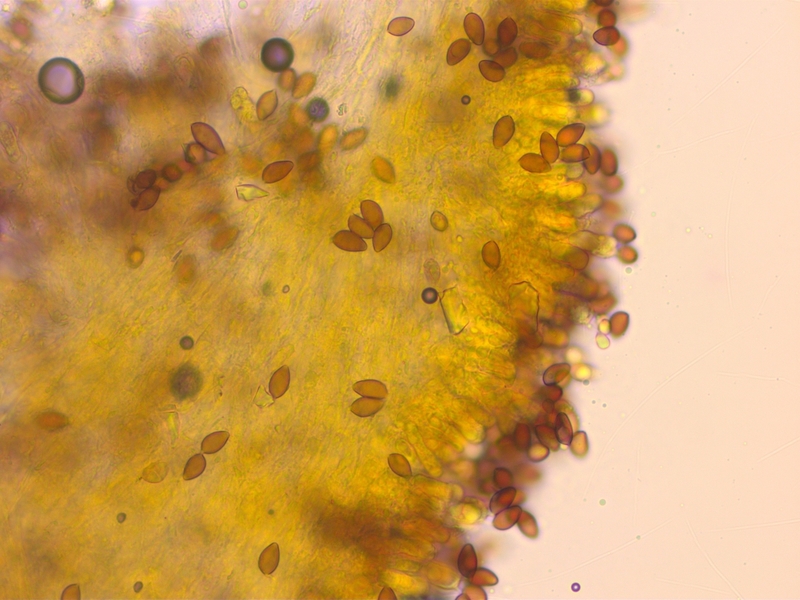
Noch eine Kollektion aus dem Mischwald, mit deutlich dunklerer Mitte und Rettichgeruch. L nicht notiert.
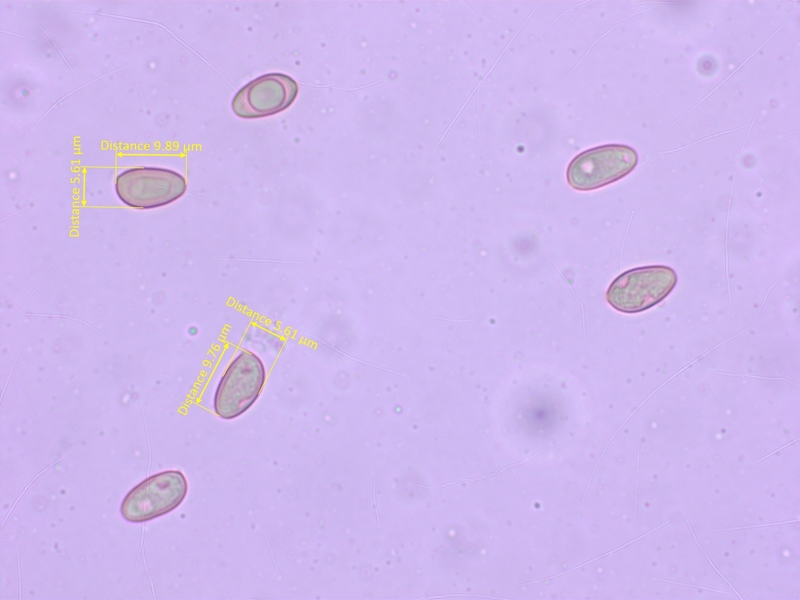
Sporen fast glatt, meistens schmaler als 6µm (O0-1, P0)
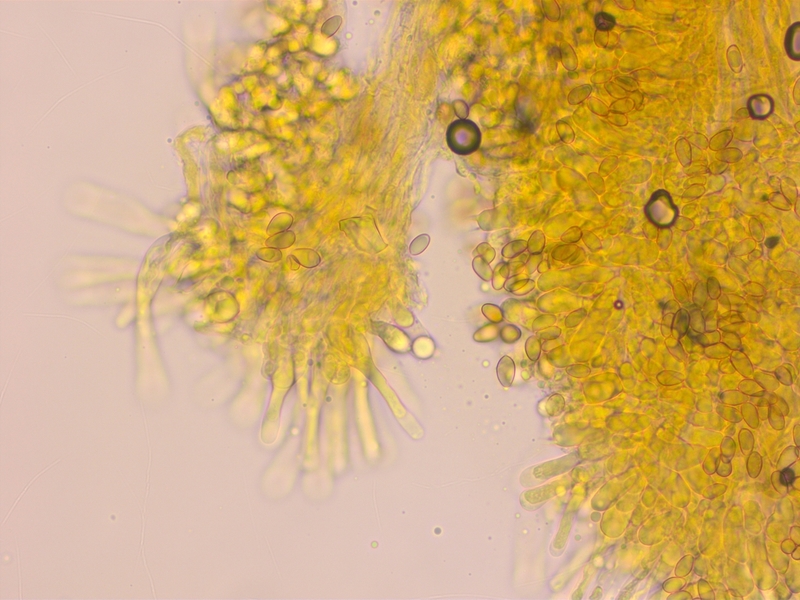
Sporen kaum dextrinoid (D0-1)
Cheilozystiden keulig-bauchig, nicht genau gemessen weil triviale Art.
Makroskopisch und mikroskopisch kann es nur Hebeloma mesophaeum sein.
[trennlinie][/trennlinie]
7:

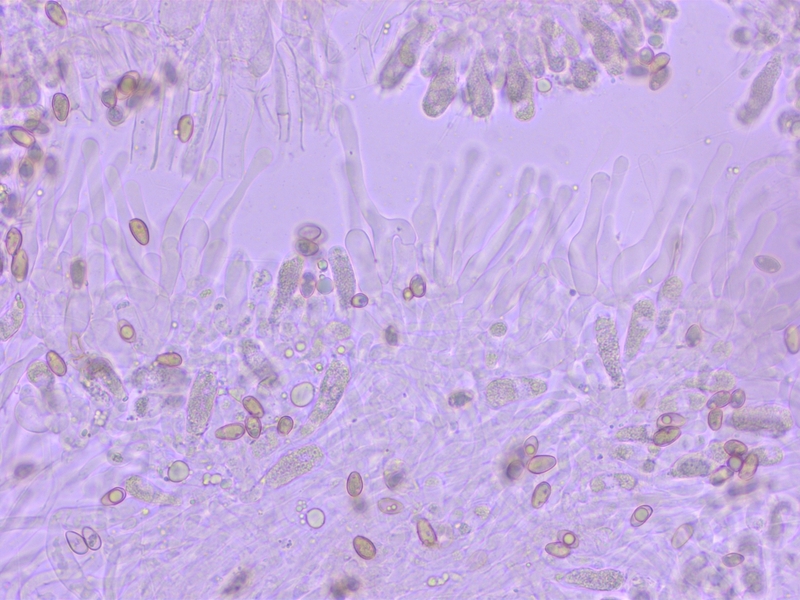
Noch so eine Gruppe die an den crustiliniforme-Komplex erinnert.
Habitat zur Abwechslung ein Mischwald aus Kiefern und Birken. Geruch (oh Wunder) nach Rettich. L leider nicht notiert, scheint aber auch nicht entscheidend zu sein.
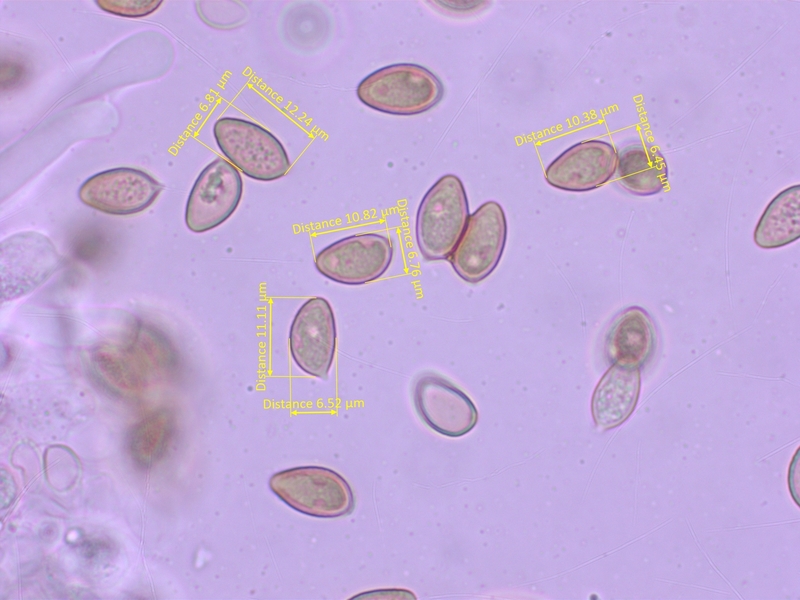
Sporen kaum ornamentiert, 10.5-13.5 x 6.3-8.0 µm, Q=1.6-1.88 (O0-1, P0)
Sporen mässig dextrinoid (D2)
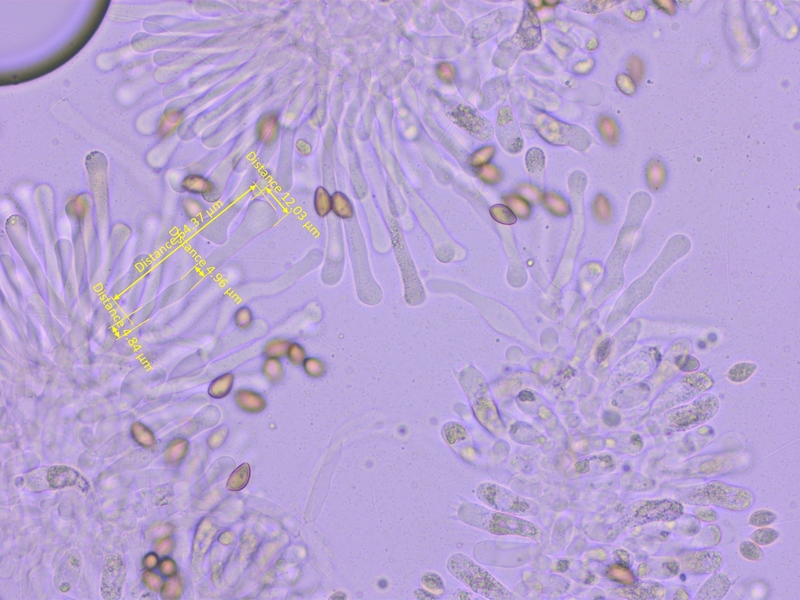
Cheilozytstiden keulig-bauchig.
Mittelwerte (n=10): L=59, A=8.21, M=4.68, B=5.76, A/M=1.86, A/B=1.59, B/M=1.23
Hier kommt nach FE14 nur Hebeloma velutipes in Frage.
[trennlinie][/trennlinie]
8:

Eine Gruppe kräftiger, fast büscheliger Fälblinge, Rettichgeruch, bei Fichten.
L=60-65
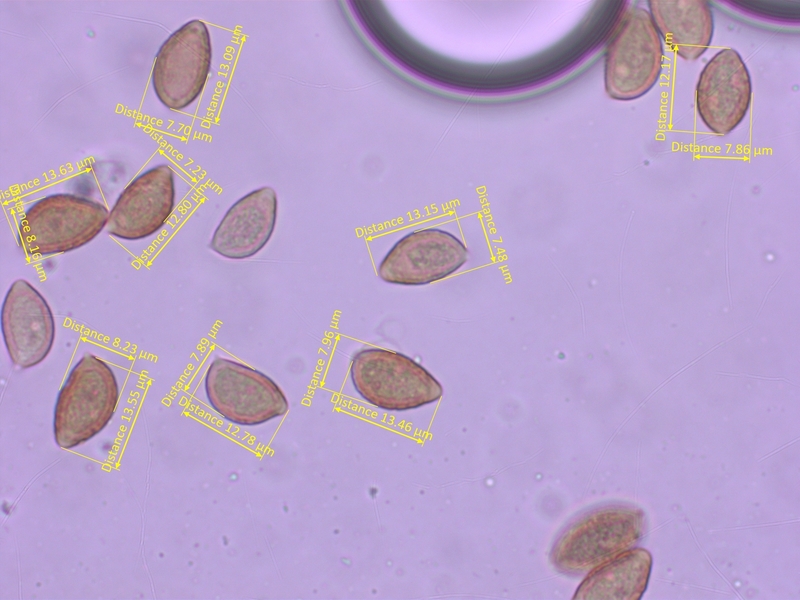
Sporen schwach ornamentiert, 11.5-14 x 7.2-8.6 µm, Q = 1.55-1.75 (O2, P0)
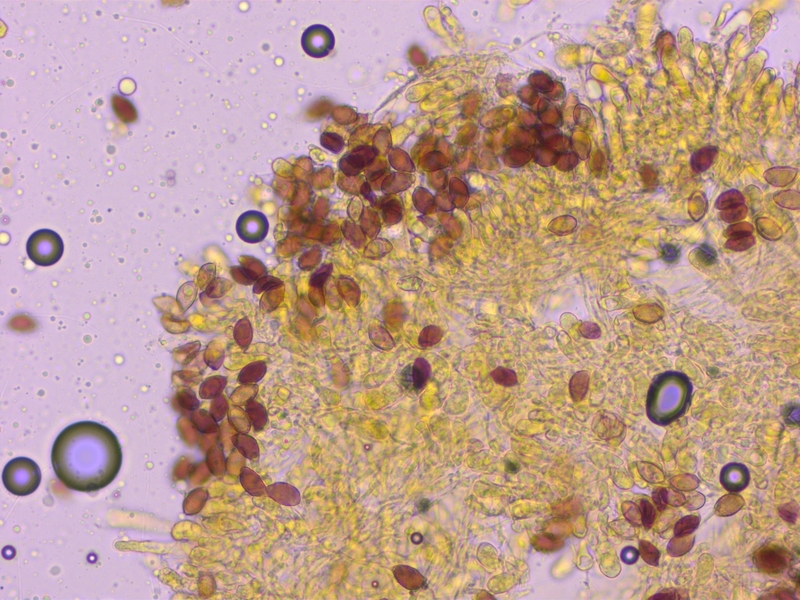
Sporen deutlich dextrinoid (D2-3)
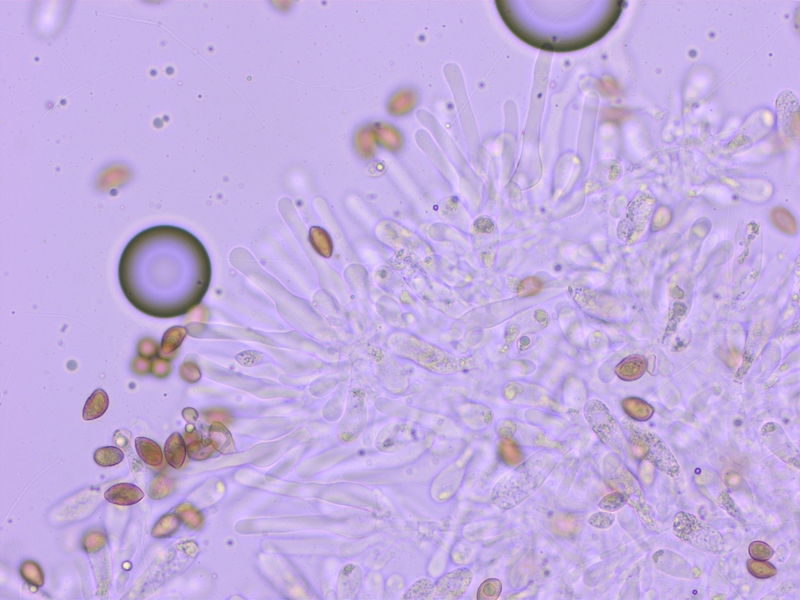
Cheilozystiden deutlich bauchig.
Mittelwerte (n=6):L=52, A=6.35, M=5.04, B=7.05, A/M=126, A/B=0.90, B/M=1.40
Hier komme ich bei Hebeloma velutipes vaccinum (danke Hias) raus.
So, nun habe ich euch genug gelangweilt. Glückwunsch an alle, die bis hier mitgelesen haben.
Gruss Raphael


