Hallo zusammen, liebe Ditte
Letzte Woche habe ich zwei Risspilze gefunden, mit denen ich mich intensiv beschäftigt habe.
Nun hoffe ich, dass meine Bestimmung zumindest in die richtige Richtung geht:
1) Inocybe cf. johannis-stanglii tiliae
- Habitat: Sonniger Flaumeichen-Wald mit Kiefern und Birken, in Gesellschaft von Lactarius zonarius und Leucopaxillus compactus, lichte Stelle am Wegrand.
- Geruch: Unauffällig
- Stielbasis deutlich gerandet knollig
Hier habe ich mich ziemlich abgemüht, weil die Gruppe um I. mixtilis wirklich nicht einfach ist und logischerweise in der üblichen Literatur fehlt.
Ähnliche Arten habe ich wie folgt ausgeschlossen, nach Esteve-Raventos, Bandini & al. 2018:
- I. mixtilis sollte grössere Höcker haben, und anders geformte Zystiden
- I. straminipes wurde wohl inzwischen zu einem Synonym von I. salicis erklärt, da passt die Ökologie nicht und die Sporen sind zu klein
- I. flavobrunnescens sollte längere, schlanke Zystiden haben
- I. nothomixtilis sollte schmalere Sporen haben
- I. ceskae kann ich nicht wirklich sicher ausschliessen. Die Zystiden passen noch besser, dafür sollten da die Sporen schmaler und stärker höckerig sein.





Sporen 8-9-10 x 5.5-6.8-8 µm, Q = 1.2-1.32-1.56
Höcker recht flach, kaum über 1µm hoch.
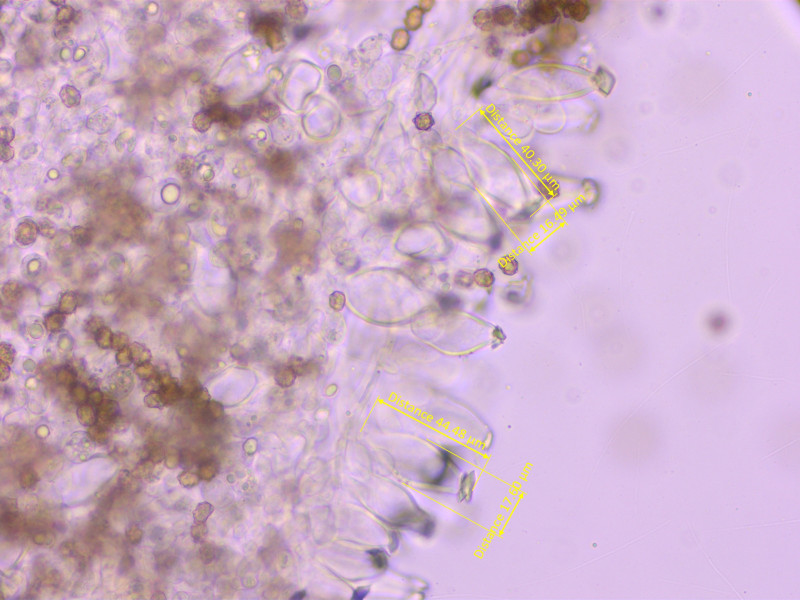
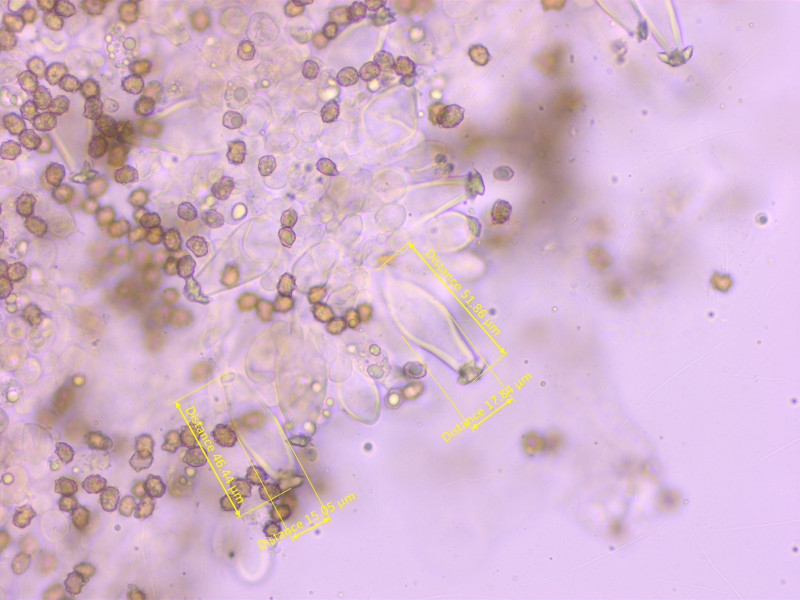
Cheilozystiden etwas zu kurz für die Art, 40-48-53 x 15-17.7-20 µm, Q = 2.3-2.7-3.4
Hals wenig aufgeprägt.
Pleurozystiden ähnlich.

Kaulozystiden oben
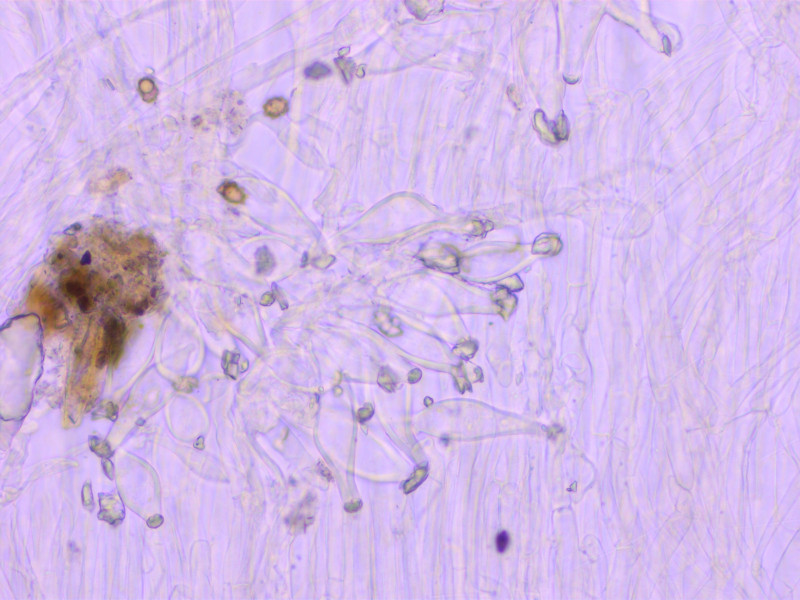
Kaulozystiden kurz über der Stielbasis
[trennlinie][/trennlinie]
2) Inocybe proximella
- Habitat: Lichter Lärchen-/Fichtenwald auf ca. 1400m
- Geruch unauffällig
- Stiel im obersten Drittel bereift, darunter nur fein überfasert
- auffällig der dunkle Buckel
- Stielbasis etwas keulig, nicht knollig



Sporen stark höckerig, 8.7-10.1-11.5 x 6-6.9-8 µm, Q = 1.3-1.47-1.6
Höcker bis über 2 µm hoch.
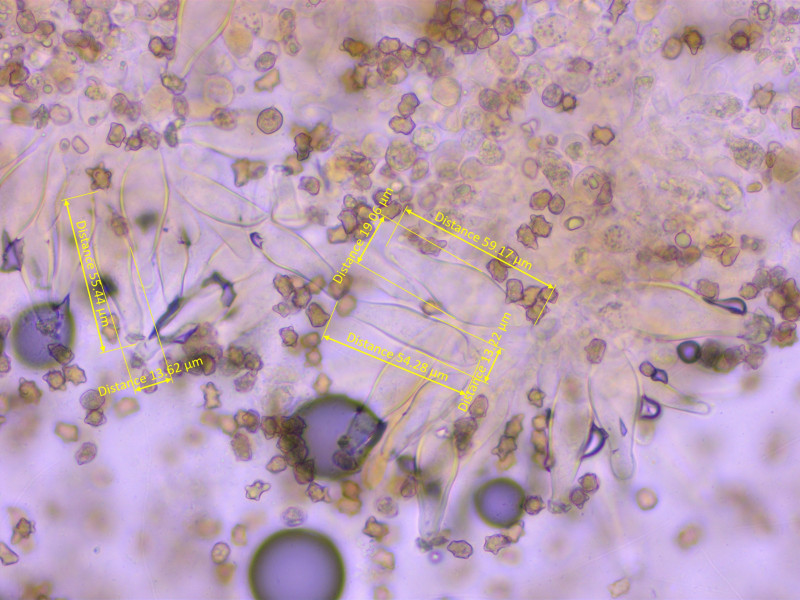
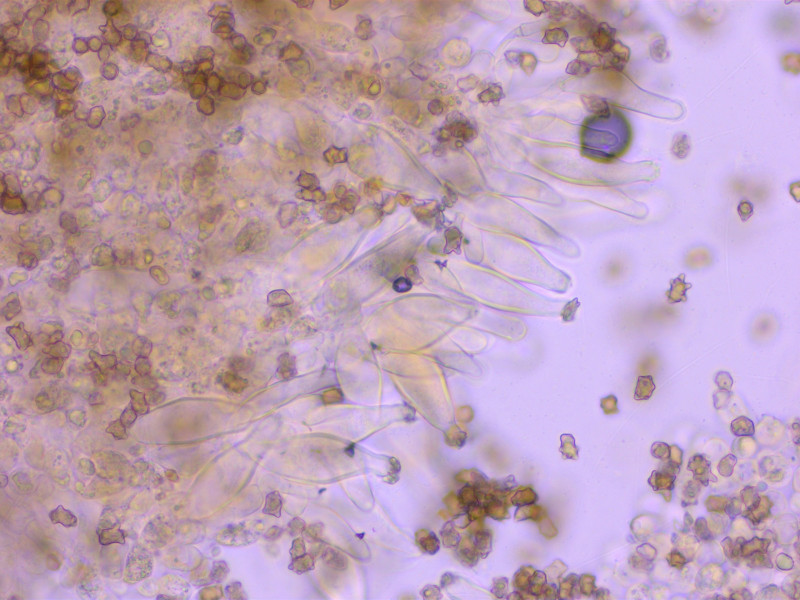
Cheilozystiden recht dünnwandig, moderat bauchig, 52-55-59 x 13-16-19 µm, Q = 3-3.5-4
Teilweise schwach kopfig.

Pleurozystiden ähnlich
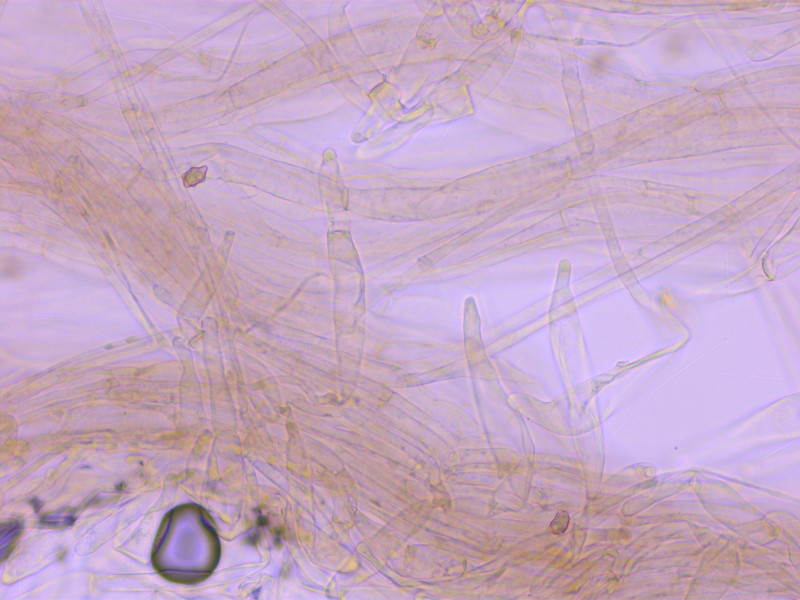
Kaulozystiden von der Stielspitze
LG, Raphael


