Hallo zusammen
Diese Woche durfte ich als Gast an der Schweizer WK-Tagung teilnehmen, die glücklicherweise ganz in meiner Nähe stattfand.
Die Bedingungen waren suboptimal. Vor der Tagung hatte es mehrere Wochen nicht geregnet.
Während der Woche regnete es dann immer wieder - genug, damit man nass wurde, aber zu spät, um Pilze hervorzuzaubern.
Wir brauchten alle Fantasie, um in den letzten schattigen Ecken noch spannende Pilze aufzutreiben. Aber am Abend kam dann doch immer eine stattliche Anzahl zusammen.
Ich konnte viele wohlbekannte und einige weniger bekannte Arten finden und dokumentieren, ein paar Highlights möchte ich gerne mit euch teilen.
Das grösste Highlight war allerdings, dass ich die Freude hatte Cortinarius persönlich kennenzulernen.
Ich habe zwei Exkursionen in alpine Gebiete gemacht, wo ich unter anderem folgendes fand:

1: Deconica chionophila
Dieser winzige Pilz parasitiert auf Moos, welches in der Folge abstirbt. Daran erkennt man ihn schon am Standort, sofern man darauf achtet.
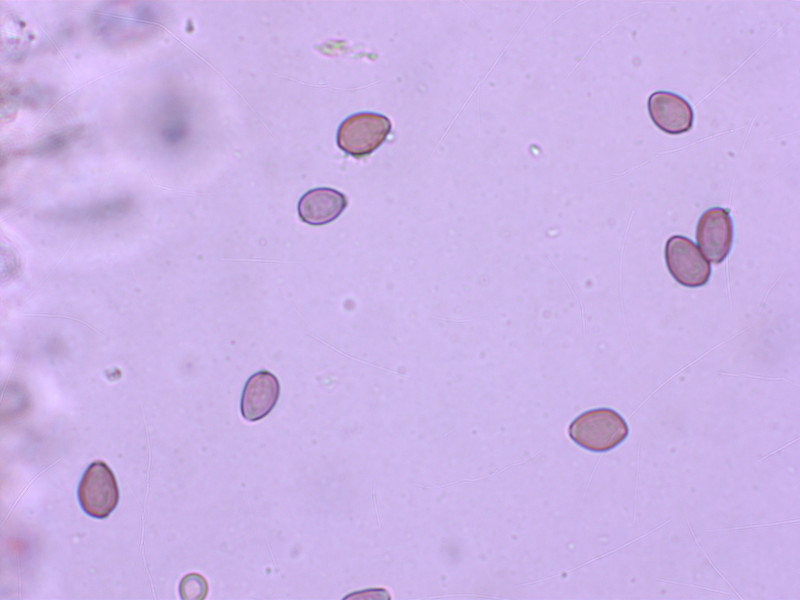
Kleine, breite, teils fast rhomboide Sporen
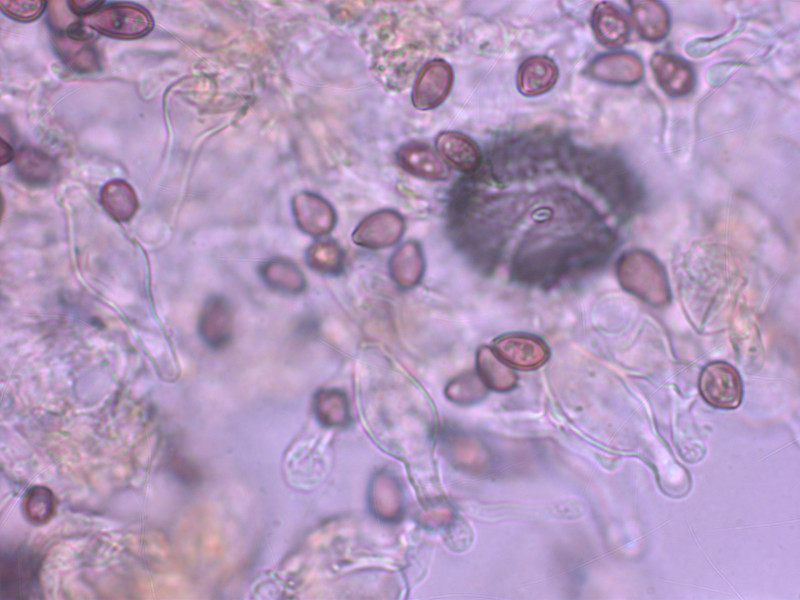
Cheilozystiden lageniform
[trennlinie][/trennlinie]

2: Cortinarius lamoureae
Diese winzige Telamonia scheint in der Gegend verbreitet zu sein. Uwe kam irgendwann auch mit einer Kollektion zu mir, aus einem anderen Gebiet.
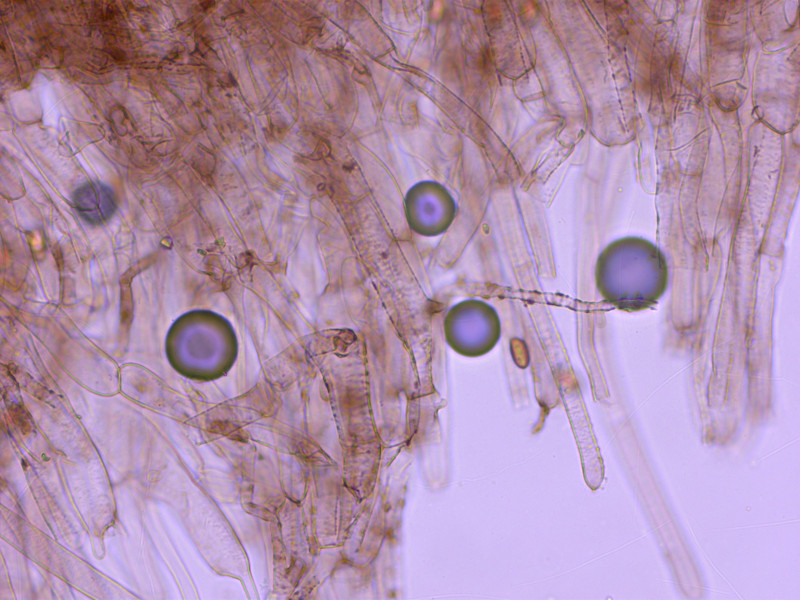
Mit den braun inkrustierten Hyphen an Hut und Stiel gehört sie in die Sektion Incrustati.
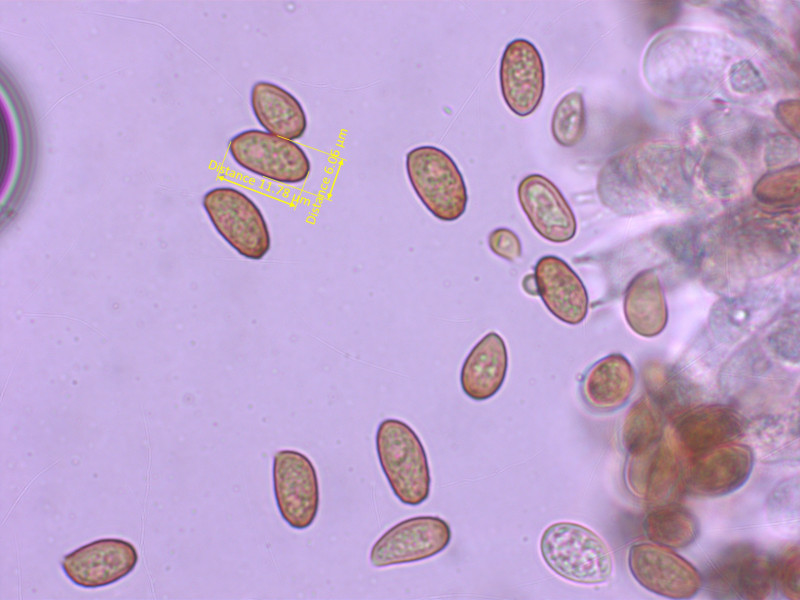
Die Sporen entsprechen exakt den Massen in der FN.
[trennlinie][/trennlinie]

3: Clitocybe dryadicola
Ein kleiner alpiner Trichterling, der nicht zwingend bei Dryas wachsen muss wie man anhand des Namens vermuten könnte.
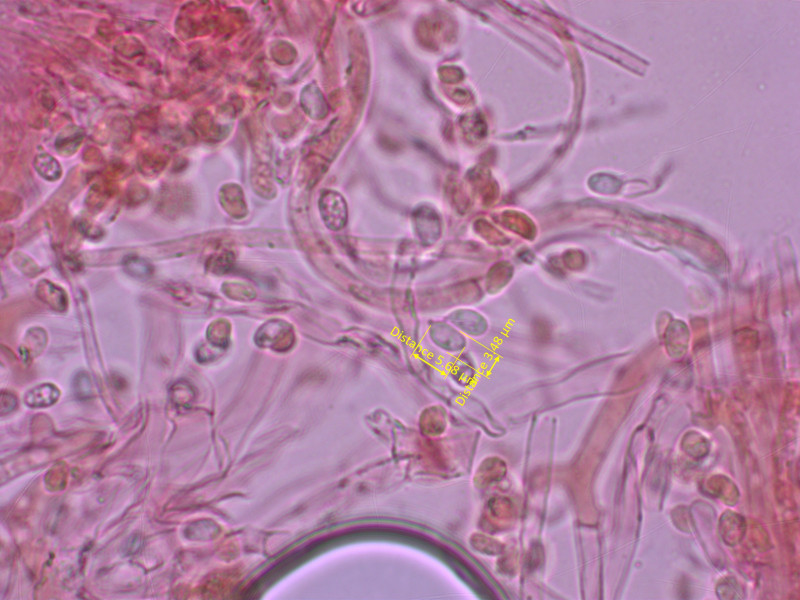
Sporen elliptisch und eher breit
[trennlinie][/trennlinie]

4: Inosperma subhirsutum

Dieser Risspilz hat (vor allem im Schnitt) einen grünen Stiel. Damit gehört er klar in die Nähe von I. calamistratum.
Geruch kräftig pelargonienartig.

Cheilozystiden keulig.
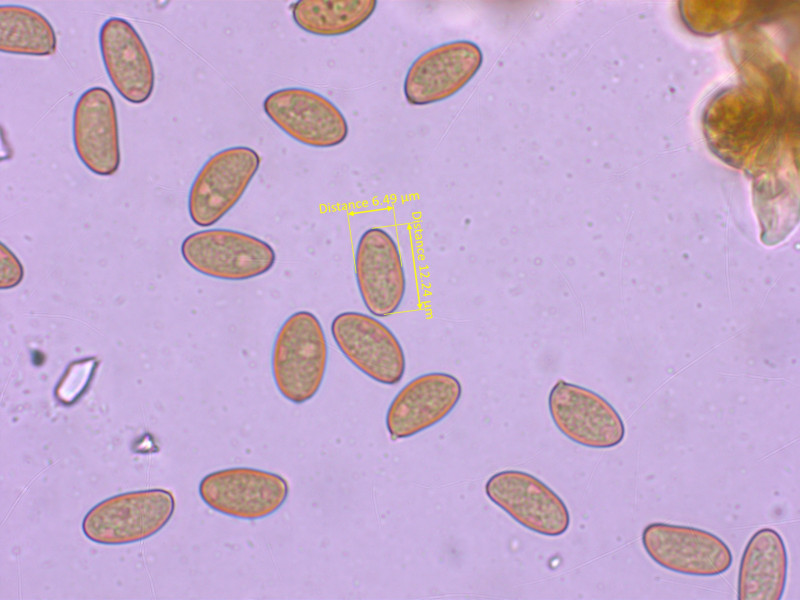
Sporen recht gross und schlank: 12.1-12.6-13.5 x 6.0-6.7-7.6 µm, Q = 1.66-1.88-2.07
[trennlinie][/trennlinie]

5: Lyophyllum schulmannii
Eine "vergessene" Art, die ich im Feld und auch bei der Bestimmung lange für einen Trichterling hielt.
Es gibt eine Reihe ähnlicher Trichterlinge (C. strigosa u.a.), aber keiner passt so richtig.
Der Pilz wurde 1969 von Harmaja beschrieben, einige Jahre später kombinierte er ihn zu Lyophyllum um.
Und zwar stellte er im Nachhinein am Typus die siderophile Granulation fest, die konnte ich auch nachweisen.
Der stark bittere Geschmack trennt ihn von ähnlichen Arten.
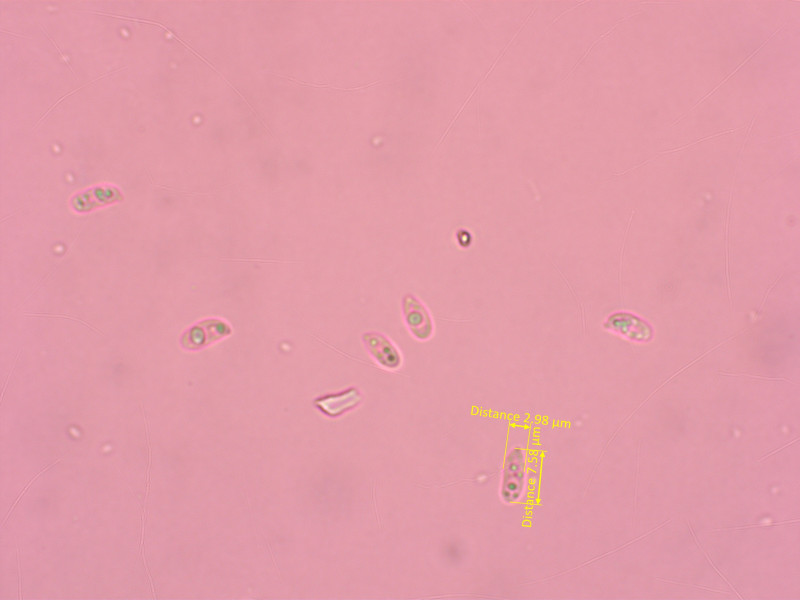
Auffallend sind die sehr langen, schlanken Sporen.
[trennlinie][/trennlinie]
Das trockene Wetter zwang uns, viel Zeit in Erlenbrüchen zu verbringen. Entsprechend gab es einige dazu passende Funde:

6: Naucoria luteolofibrillosa
Die Art wurde von diversen Teilnehmern gefunden und bestimmt.

Sporen deutlich warzig und eher breit

Cheilozystiden zugespitzt
[trennlinie][/trennlinie]

7: Naucoria submelinoides
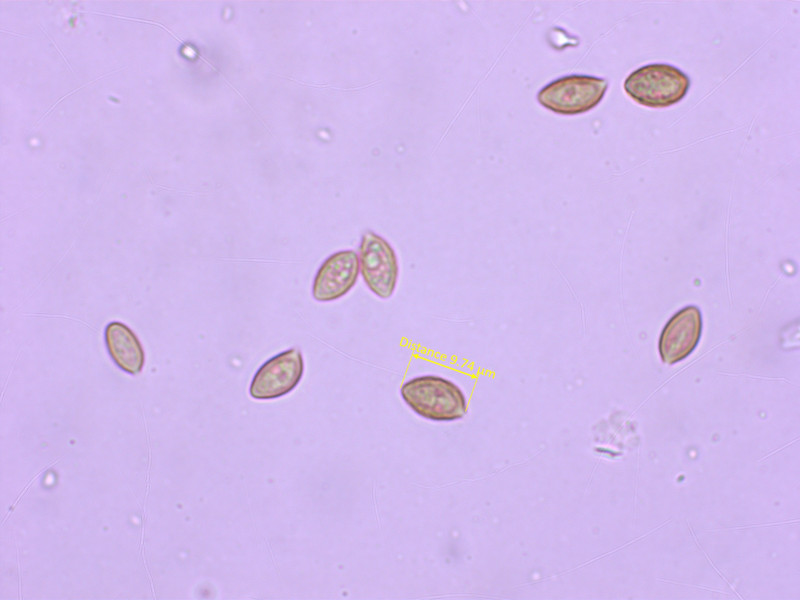
Sporen weniger warzig und etwas schlanker
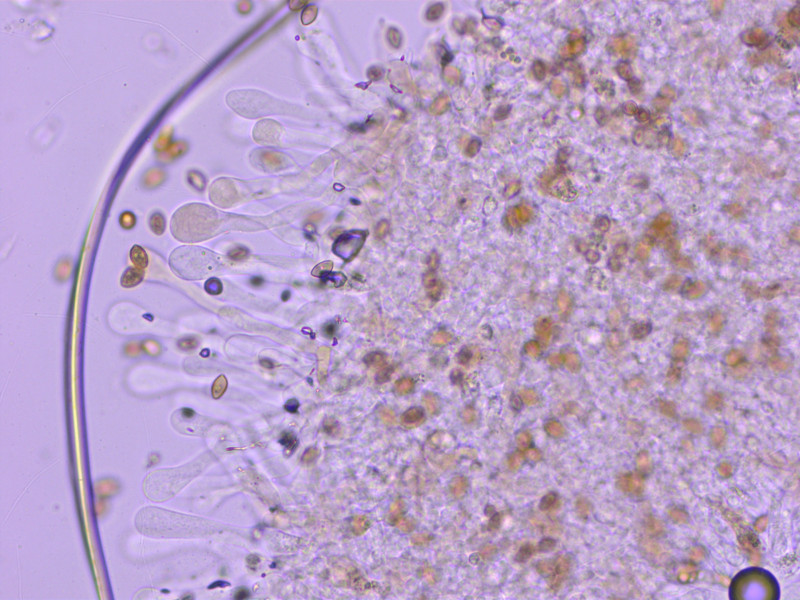
Cheilozystiden keulig.
[trennlinie][/trennlinie]
Und schliesslich noch ein paar weitere Sachen aus verschiedenen Habitaten:

8: Inocybe soluta
Naja, zumindest habe ich ihn so bestimmt.
Habitat: Fichtenstreu auf ca. 1600m.
Geruch unauffällig.
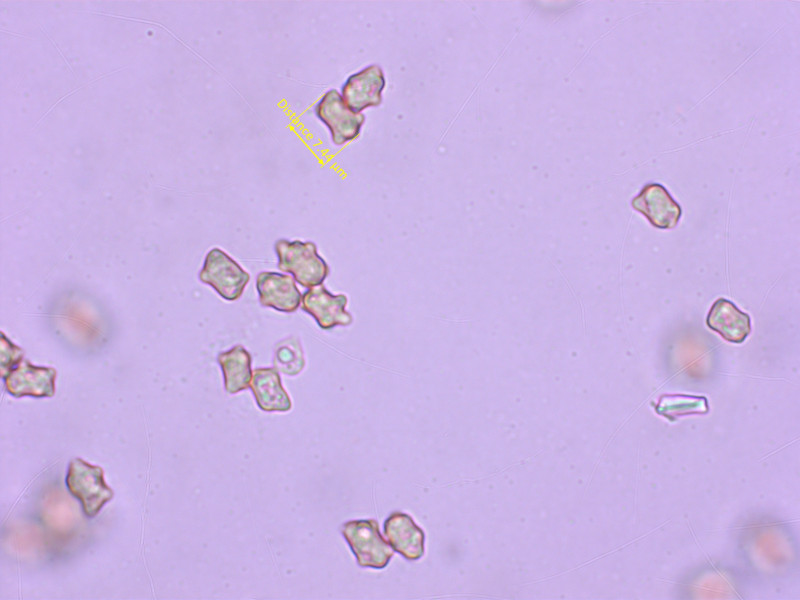
Sporen teils deutlich höckerig, teils nur eckig, 6.8-7.6-8.4 x 4.4-5.2-5.8 µm, Q = 1.32-1.48-1.64

Cheilozystiden nur selten mit Kristallen, 45-65 x 14-18 µm
20210913 Pleuro2 KOH 400.jpg
Pleurozystiden ähnlich.
[trennlinie][/trennlinie]

9: Galerina badipes
Ganz nahe verwandt mit G. marginata. Aber der Ring verschwindet sehr früh und der Stiel wird rasch von unten dunkel.
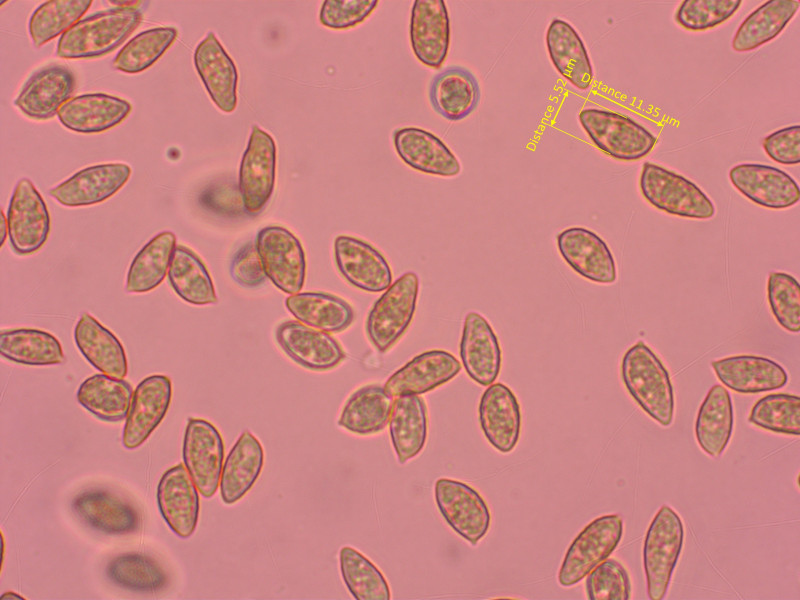
Sporen moderat warzig
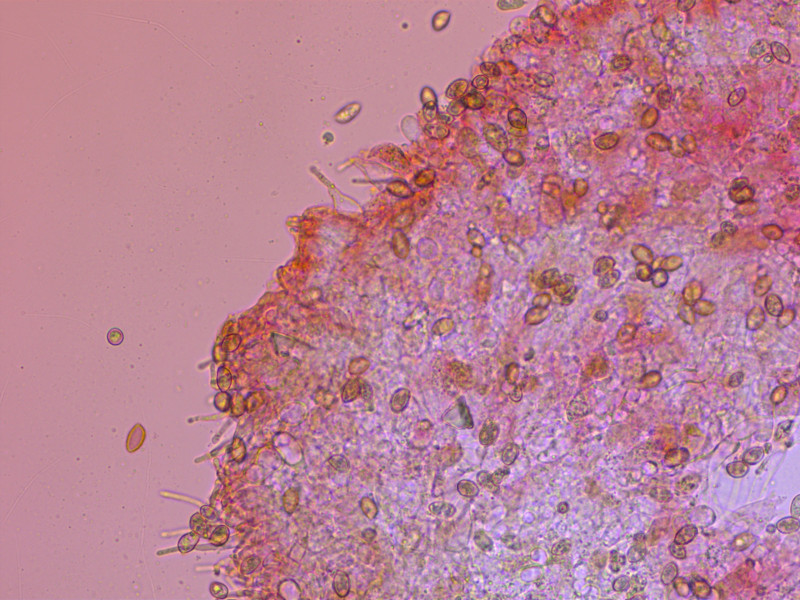
Cheilozystiden lageniform
[trennlinie][/trennlinie]

10: Leucocoprinus caepistipes
Der wuchs zuoberst auf einem riesigen Haufen von Holzschnitzeln.
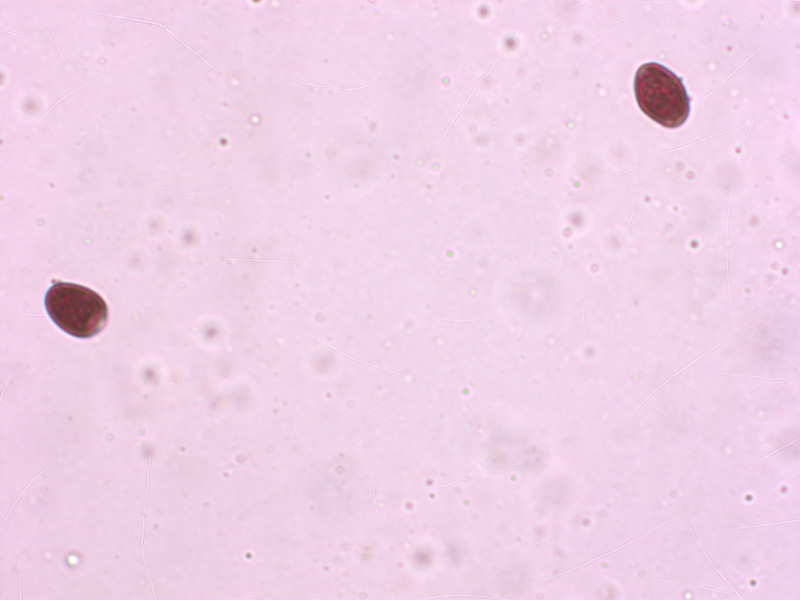
Sporen habe ich nur wenige erwischt, weil ich in Eile war. Hier in Melzer, stark dextrinoid.
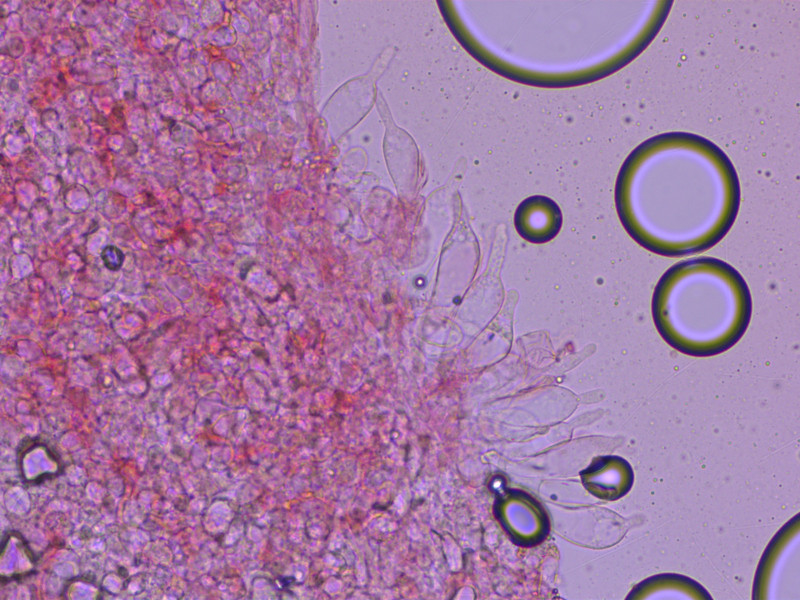
Cheilozystiden in Kongorot.
Danke an alle, die genug Geduld hatten um bis hier mitzulesen.
Korrekturen/Anmerkungen wie immer erwünscht.
Gruss Raphael


