Hallo zusammen
Der drohende Frost hat mich heute dazu bewogen, nochmal in den Wald zu gehen (Föhren, Fichten, Birken auf Kalk).
Wie überall findet man viele Pilzleichen, denen es schon zu kalt war. Aber ein paar Sachen lebten noch:
1: Agaricus sylvaticus (oder silvaticus, wessen Schreibweise stimmt nun eigentlich?)
Sagt mir zumindest die Funga Nordica. In der unbeliebten FE1 habe ich nichts gefunden was dagegen spricht.
Ist ja auch nicht selten, also wird's schon passen.
2: Cortinarius cf. roseipes
Hier fiel mir sofort auf, dass sich der Stiel im Schnitt intensiv rot verfärbt. Mit der FN komme ich deshalb direkt zu C. roseipes.
Leider finde ich nur wenig Infos zu dieser Art. Angeblich soll sie mit Helianthinum verbandelt sein. Das kommt an dem Standort aber wohl kaum vor, es war ein sandiges Bachufer mit Erlen, Birken und Föhren.
Vielleicht hat jemand eine bessere Idee.
3: Inocybe pusio agg.
Das bilde ich mir zumindest ein, vielleicht ist Ditte so lieb das zu kontrollieren:
- Hut 15-25 mm
- Stiel oben eigentümlich gefärbt (ich bin gänzlich unfähig, Farben korrekt zu benennen, also versuche ich es gar nicht)
- Geruch banal spermatisch
- Kaulozystiden nur an der obersten Spitze vorhanden und auch dort spärlich.
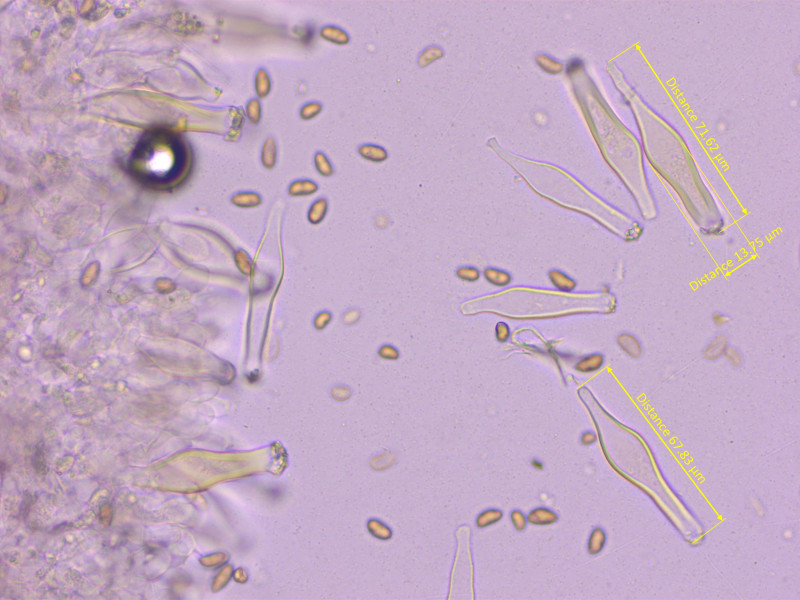
- Cheilozystiden recht lang und schlank
- Pleurozystiden ähnlich, zahlreich
- Sporen: 9-10.5 x 5-6 µm, Avg 10x5.5 µm, Q = 1.64-2.09, QAvg = 1.83
- Im Schnitt keine Verfärbung



Sporen:

Cheilozystiden:
Pleurozystiden:

Kaulozystiden von der obersten Spitze (1/10)
4: Hygrophorus discoideus:

Sporen:

Die Wetterfrösche drohen ab dem Wochenende mit Minustemperaturen. Die Saison ist wohl wirklich fast vorbei. 
Gruss Raphael


