Hallo zusammen
Risspilze haben offenbar hier Hochsaison. Manche Wälder sind voll mit wunderschönen Kollektionen, da konnte ich nicht widerstehen.
Vieles stammt von der Exkursion hier, wo ich schon andere Sachen gezeigt habe: Val d'Hérens 20.07.2024
Ditte , falls du dir einmal Zeit nehmen kannst/willst, wäre ich froh. Eilt aber nicht und muss auch nicht unbedingt sein, das meiste wird im Winter ohnehin sequenziert.
Einige Kollektionen habe ich als triviale Arten bestimmt (z.B. mehrmals nitidiuscula), die zeige ich jetzt nicht alle.
1:

Diese Gruppe aus dem geophylla-Aggregat wuchs kurz unter der Waldgrenze bei Larix und Picea, ca. 2100m.


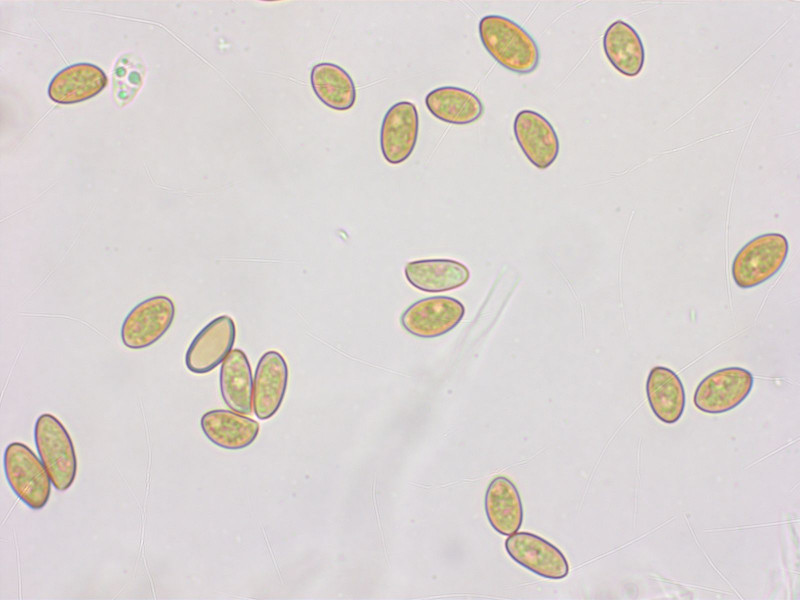
Sporen: 7.8-8.7-10.0 x 5.3-5.0-5.9 µm, Q = 1.44-1.73-2.22 (n=20)
Cheilos:
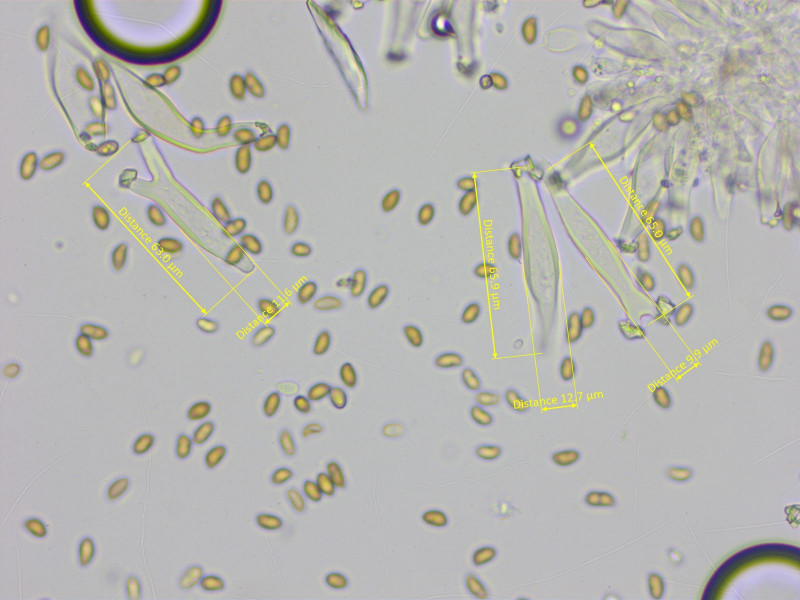
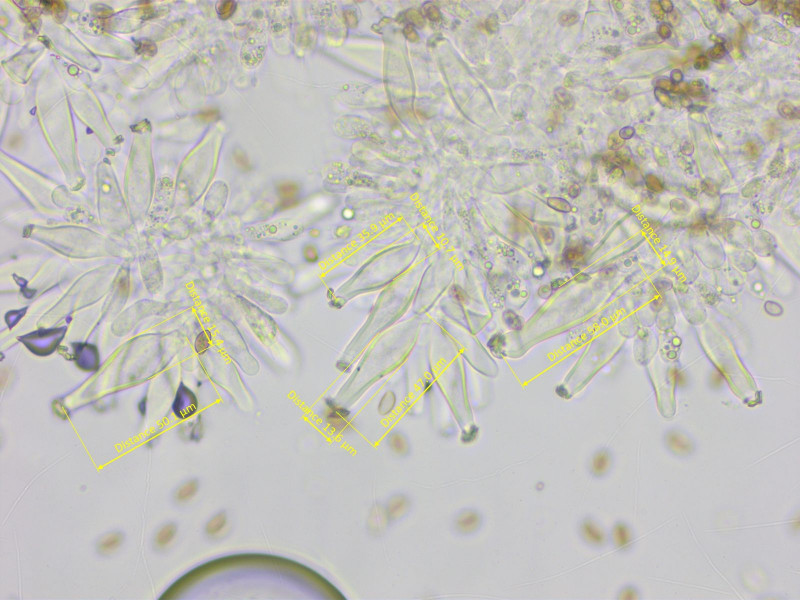
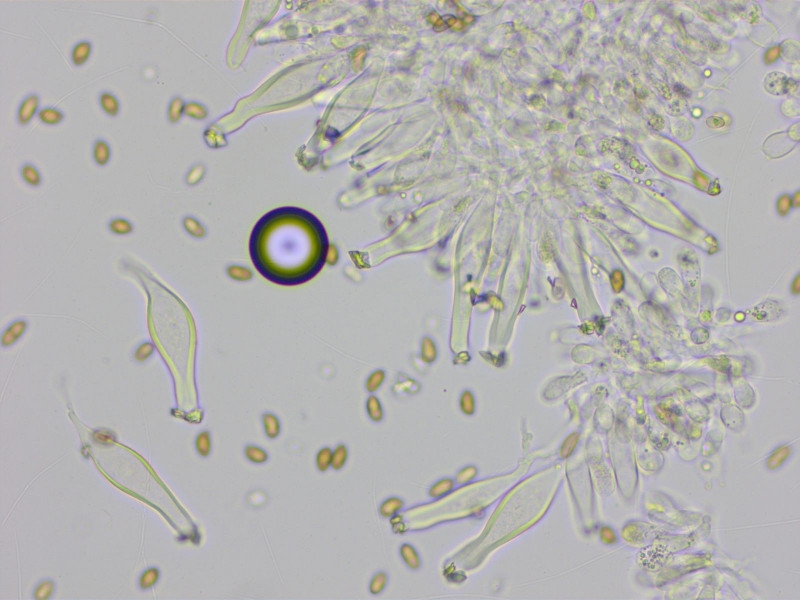
Die Zystiden sind recht oft am Apex gegabelt, 36-55-66 x 10-13-15 µm (n=10)
Kaulos:

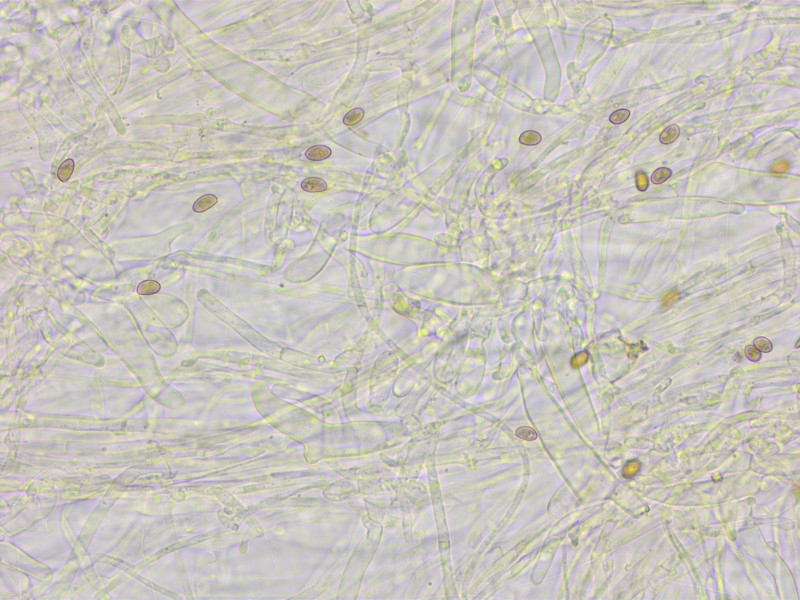
Die Kaulozystiden sind in der Gruppe ja wichtig. Sie sie recht vielgestaltig.
Einige metuloid mit wenigen Kristallen, andere schlanker und teilweise auch septiert oder gegabelt.
Die Sporenmasse und auch die Kaulozystiden finde ich recht passend für Inocybe cygnea.
Aber in dieser schwierigen Gruppe fühle ich mich doch ziemlich unsicher.
2:

Diese schöne Gruppe wcuhs am Wegrand auf ca. 2200m bei Strauchweiden, in der Nähe auch Salix herbacea und Dryas.
Geruch spermatisch.


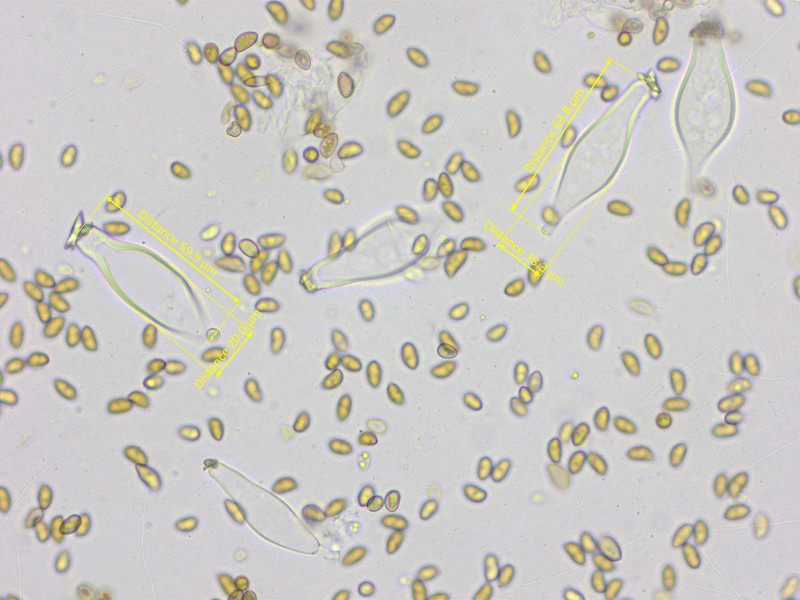
Sporen: 8.3-9.2-10.1 x 4.7-5.2-5.7 µm, Q = 1.53-1.76-1.94 (n=20)
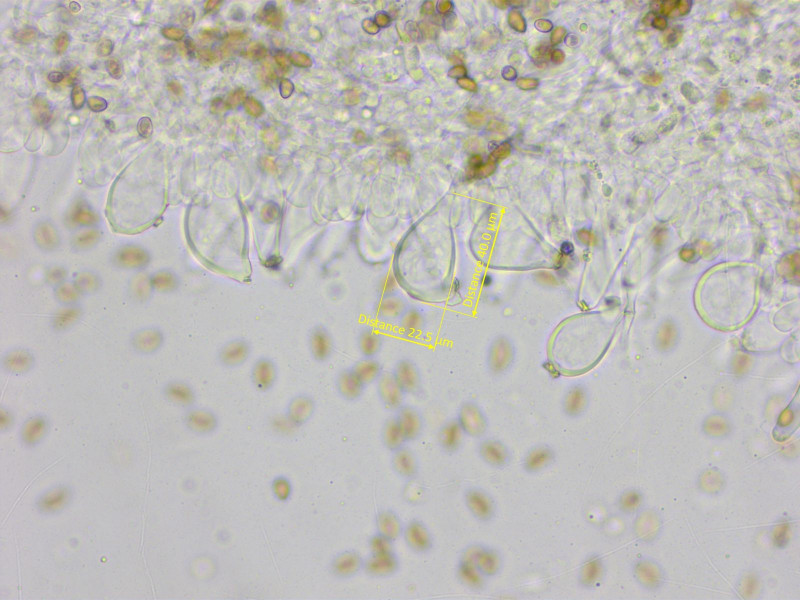
Stellenweise waren viele Cheilozystiden fast rundlich.
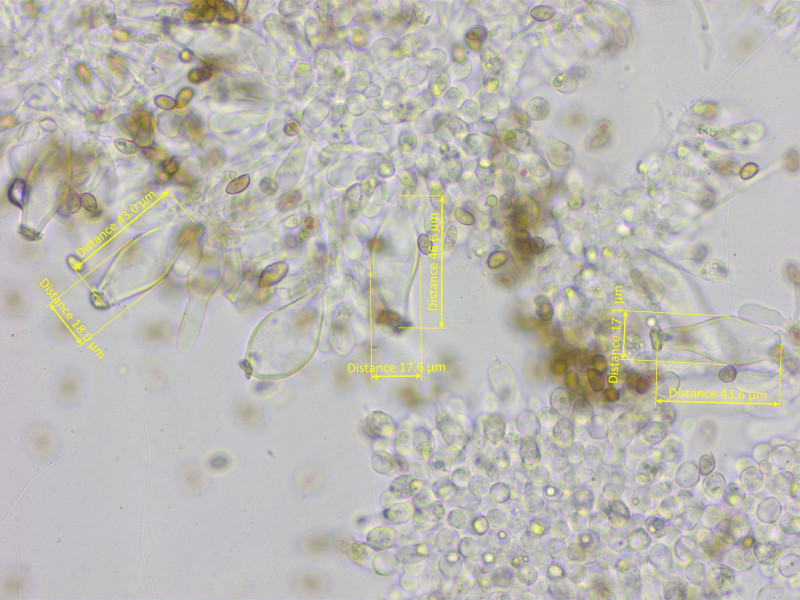
Die Mehrzahl aber doch lageniform. Habe mal nur diese gemessen: 43-46-51 x 15-17-18 µm
Die Pleurozystiden sind ebenfalls meist lageniform.
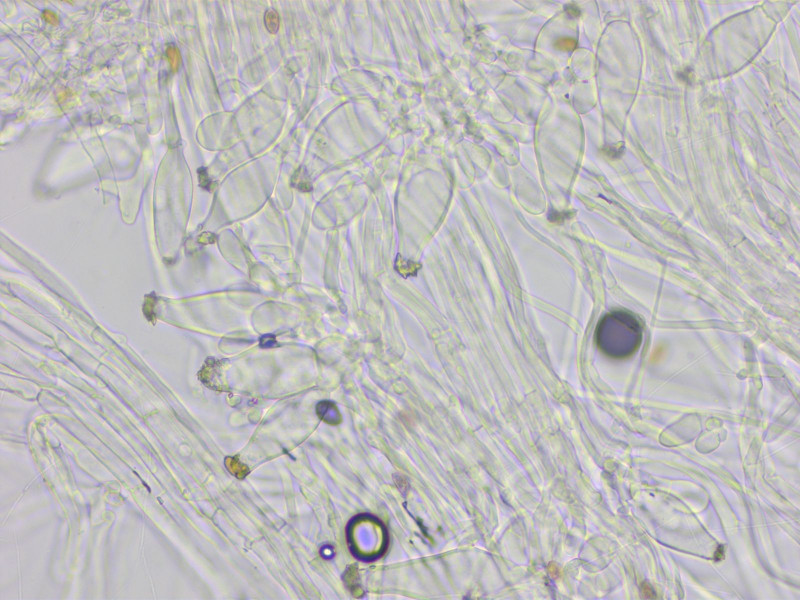
Kaulozystiden nur im oberen Drittel, metuloid mit vielen keuligen Parazystiden.
Ich denke das gehört in die Nähe von Inocybe tigrina, aber eine wirklich passende Art habe ich noch nicht gefunden.
Die restlichen Kollektionen sind alle von der gleichen Fläche. Fichtenwald auf ca. 1600m, müsste kalkig sein.
Durch die Fläche führt ein kleiner Bach, an dem auch Erlen und Birken wachsen.
3:

Von diesem hier habe ich drei Kollektionen, die mikroskopisch identisch sind.
Ich dachte im Feld an Inocybe proximella, aber das stimmt wohl nicht.
Geruch spermatisch.

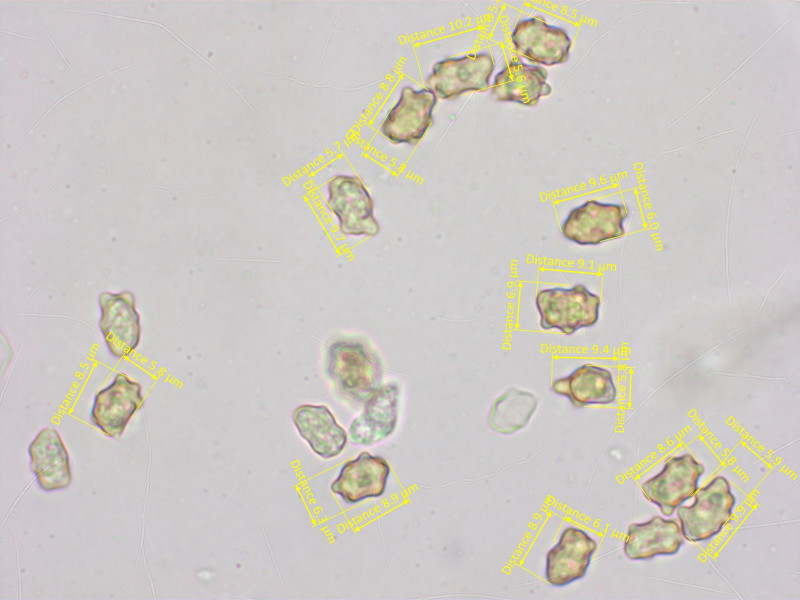
Sporen grob höckerig, 7.7-8.9-10.2 x 5.4-6.0-6.9 µm, Q = 1.27-1.48-1.82 (n=20)

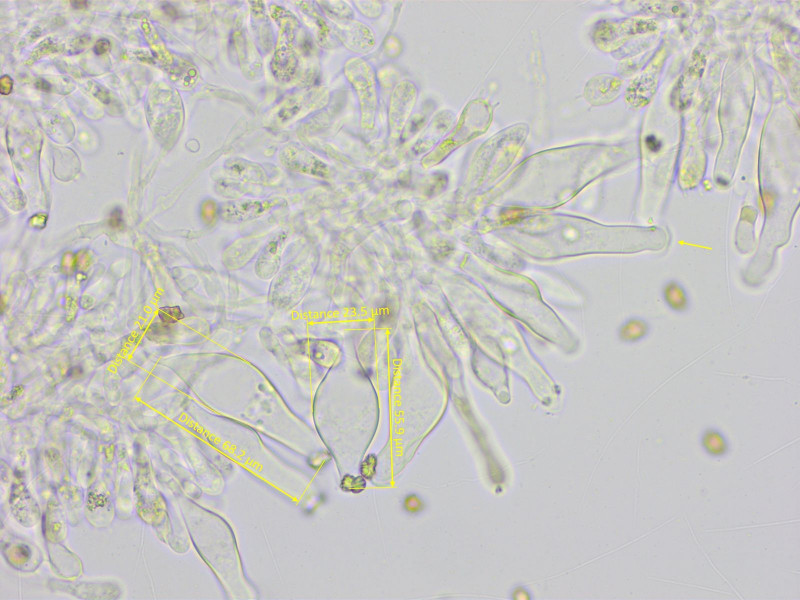
Cheilozystiden recht dünnwandig, 55-62-69 x 17-21-28 µm. Viele Zystiden mit kappenartigem Apex.

Pleurozystiden ähnlich und meistens ohne Kristalle.

Kaulozystiden im oberen Drittel grösstenteils sehr schlank, septiert und mit verjüngten Terminalzellen.
Ich meine das ist wieder Inocybe amicta, kann das sein?
4:

Noch ein spermatisch riechender Risspilz.

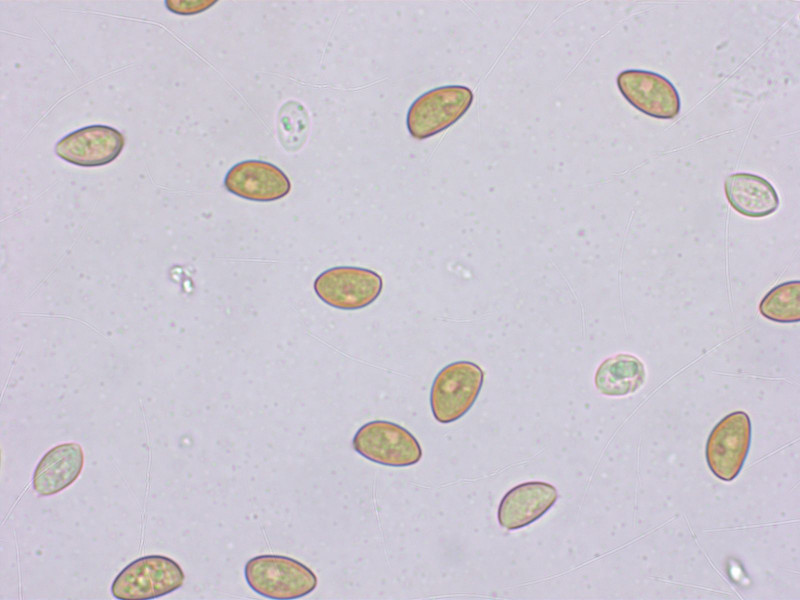
Sporen: 9.0-9.8-10.8 x 5.5-6.0-6.5 µm, Q = 1.54-1.65-1.80 (n=20)
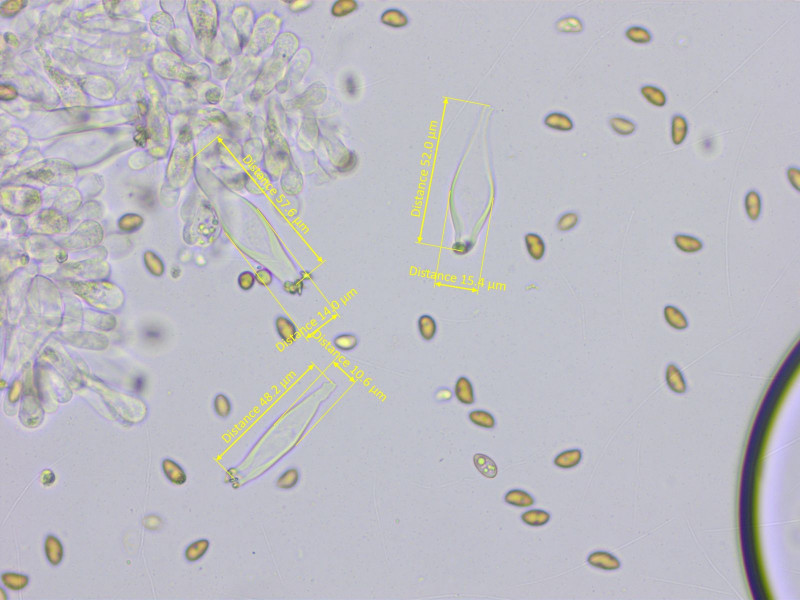

Cheilozystiden lageniform mit vielen Parazystiden, 46-54-60 x 11-14-16 µm.

Pleurozystiden ähnlich.
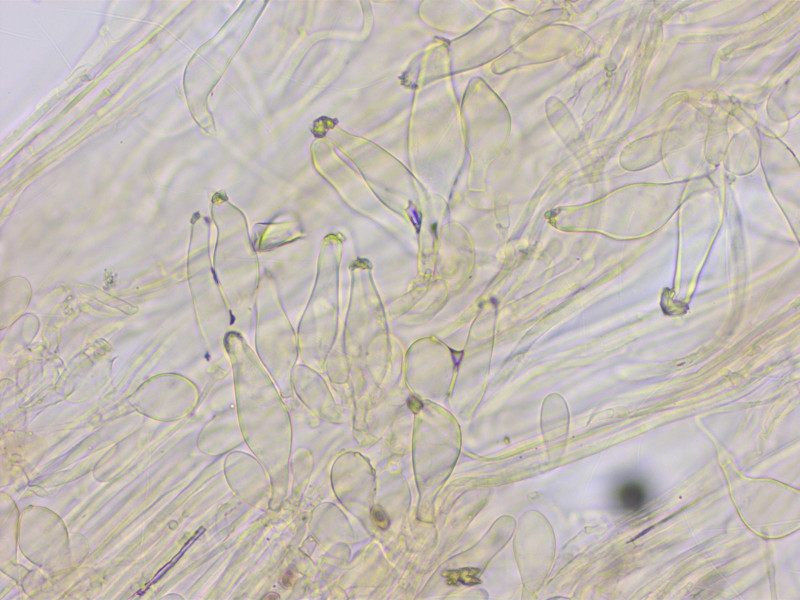
Kaulozystiden im oberen Drittel, ähnlich den Hymenialzystiden.
Im Moment tendiere ich hier zu Inocybe involuta.
5:

Leider nur zwei Fruchtkörper, aber ich finde den spannend. Geruch schon wieder spermatisch.


Die Sporen sind recht blass und sehr unregelmässig geformt. Die Höcker sind oft eher nur warzig.
7.4-8.6-9.9 x 4.8-5.6-6.7 µm, Q = 1.36-1.54-1.73 (n=20)

Cheilozystiden in KOH kräftig gelb, recht klein und schlank, mit abgestutzter Basis. 36-43-50 x 10-11-13 µm.

Pleurozystiden ebenso.

Kaulozystiden im oberen Drittel, unter der Mitte nur ganz vereinzelte.
Hier habe ich nach Funga Nordica geschlüsselt und lande bei Inocybe nematoloma, einer Art zu der ich nur wenig glaubwürdige Informationen finde.
So richtig überzeugt mich die Darstellung von Ferrari nicht, die scheinen mir die Sporen und Zystiden deutlich anders als die Original-Beschreibung von Josserand zu sein.
So viel für jetzt, mein Zug kommt gleich an. Am Abend folgt der Rest.
LG Raphael
![]()


