Liebe Forumsmitglieder,
ich habe versucht eine Tomentella zu bestimmen, komme aber zu keinem eindeutigen Ergebnis. Das liegt sicher auch daran, dass es erst die dritte Tomentella ist, die ich mikroskopiert habe und ich in der Interpretation und Differenzierung der Strukturen nicht sicher genug bin. Vielleicht findet der Pilz mit den Fotos und Mikrobildern mit eurer Hilfe doch noch einen Namen.
Fundort: Montaner Fichten-/Buchenwald neben Bachlauf 1000m SH, Wechselgebiet Niederösterreich
Substrat Fagus, tw.auf Laub oder finalmorschen Holz
Hymenophor: haselnussbraun (mehr Gelbkomponente als auf den Fotos), körnig, lässt sich leicht vom Substrat ablösen, Rand heller und fein byssoid
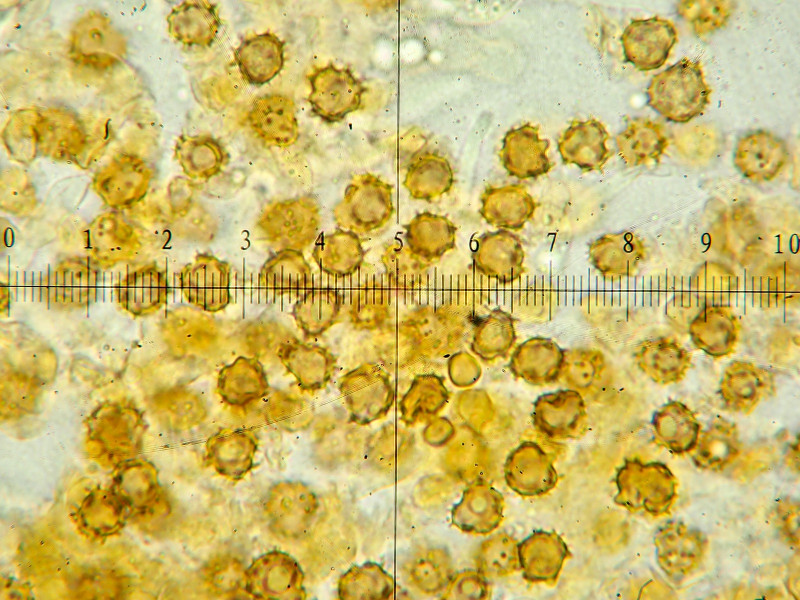
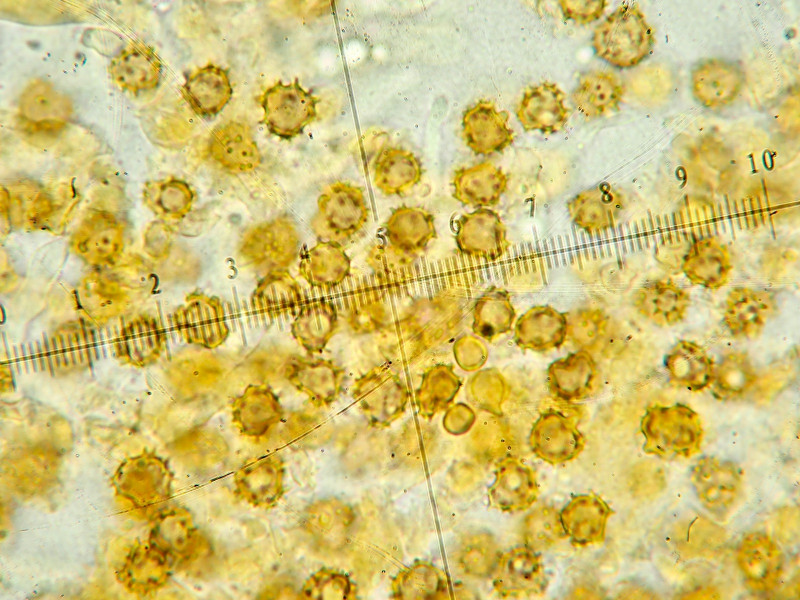
Sporen: rundlich bis lappig, 6-7ym, Stacheln 1,0-1,5ym
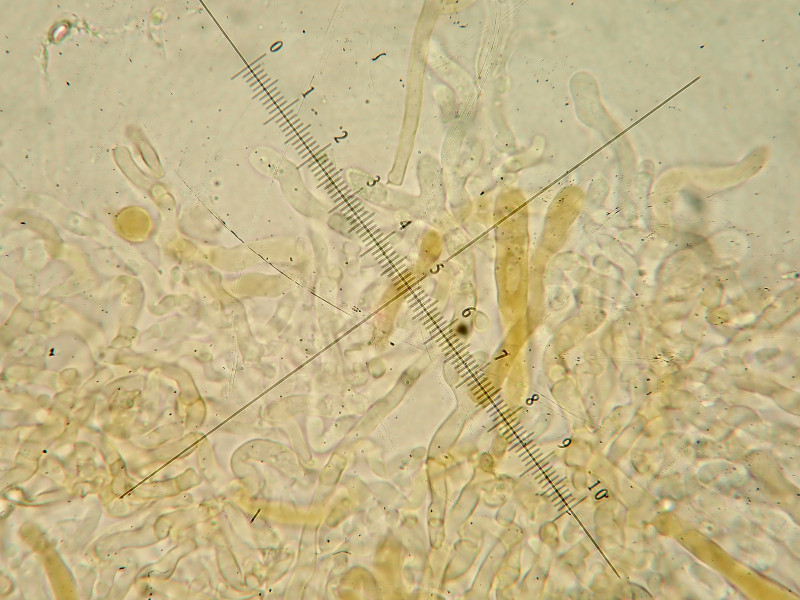
Rhizomorphen: es sind vereinzelt hyaline bis hellbraune gewundene skeletthyphenartige Stränge zu erkennen mit einem Durchmesser von 3-5ym
Zystiden: Mit der Stereolupe ist erkennbar, dass die Oberfläche des Hymenophors dicht mit ganz feinen Häarchen besetzt ist.
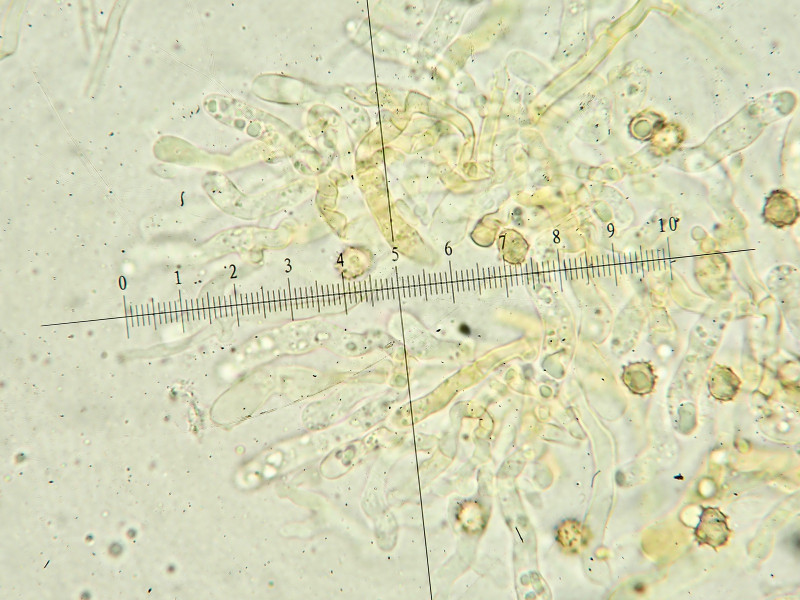
Wenn ich richtig interpretiere, sind auch auf den Mikrobildern Zystiden zu erkennen, tw. bräunlich, tw. mit körnigem Inhalt und ganz schwach cyanescent, Abgrenzung zu unreifen Basidien oder normalen Hyphenenden? Zylindrisch bis leicht kopfig, etwa 40ym lang und 3-5ym dick
Hyphen hyalin oder bräunlich, meist 2-5ym, dünn- bis dickwandig Schnallen: an den meisten Septen vorhanden, nicht inkrustiert
Basidien mit Basalschnalle
Wenn ich richtig interpretiere, dass Zystiden vorhanden sind, komme ich im online-Schlüssel auf tomentella.de am ehesten zu Tomentella pilosa
Die Sporen und deren Stacheln sind aber zu klein und die Zystiden sind zu wenig kopfig. Gehe ich den Pfad zu den Arten ohne Zystiden finde ich auch nichts genau passendes.
Welche Art könnte es sein?
Mikro-Bilder: in 3% KOH
Schöne Grüße
Christian


Rand heller, byssoid

Sporen rundlich bis lappig, 6-7ym, Stacheln 1,0-1,5ym
Basidien bzw. Zystiden mit körnigem Inhalt, hyalin
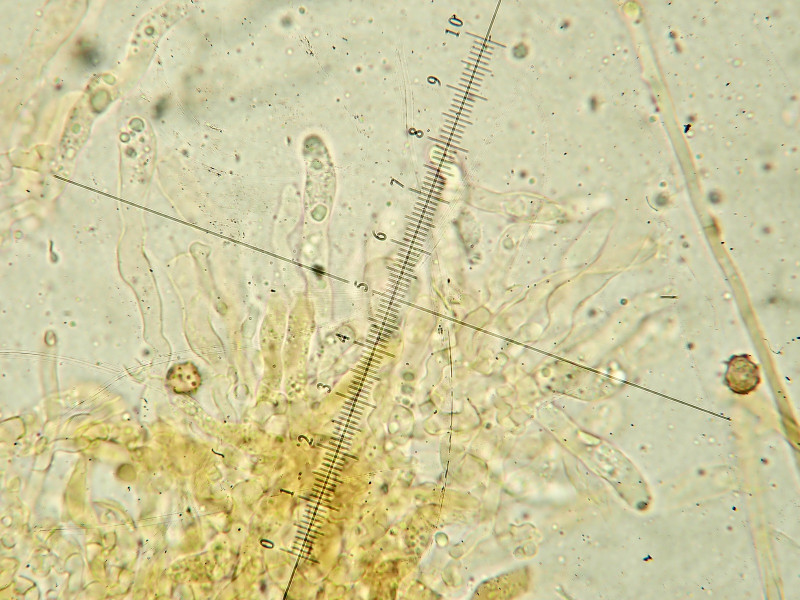
Hyphenstruktur mit Schnallen
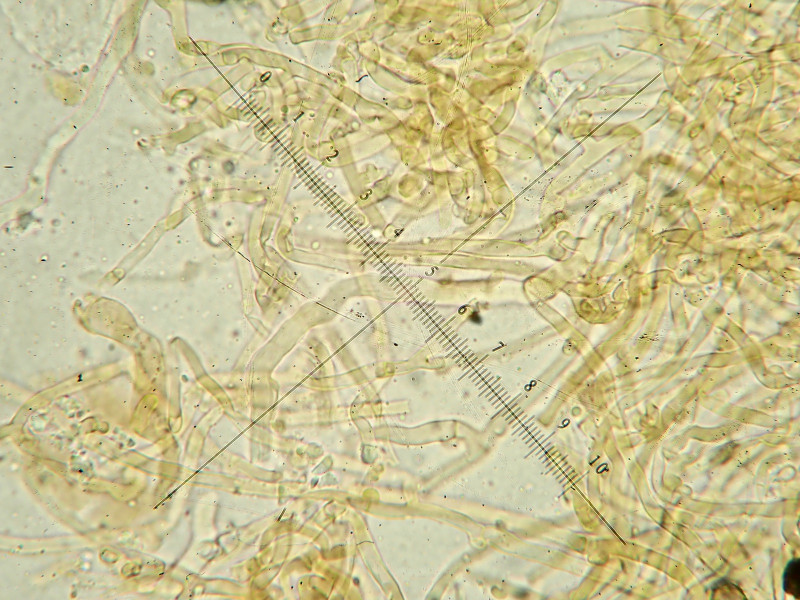
leicht cyanscenter Inhalt der Basidien/Hyphen
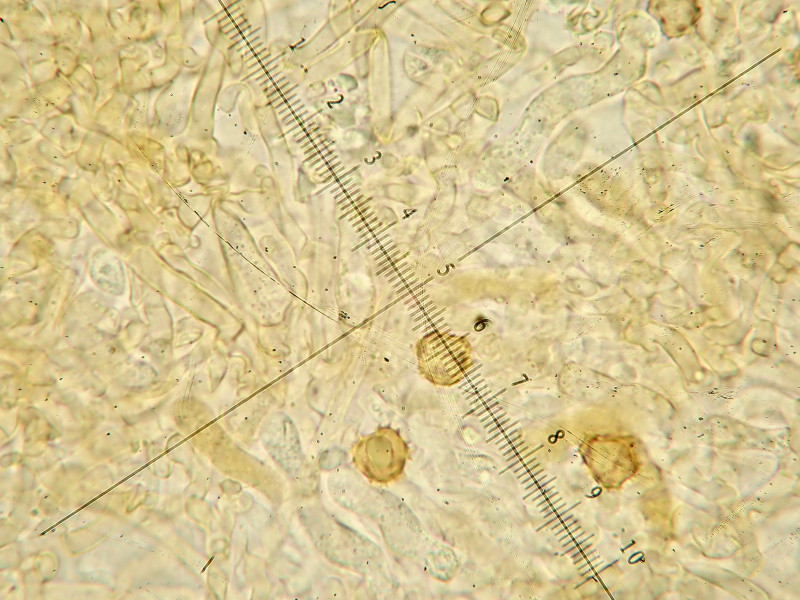
Hyphenenden (Zystiden?) tw. auch bräunlich
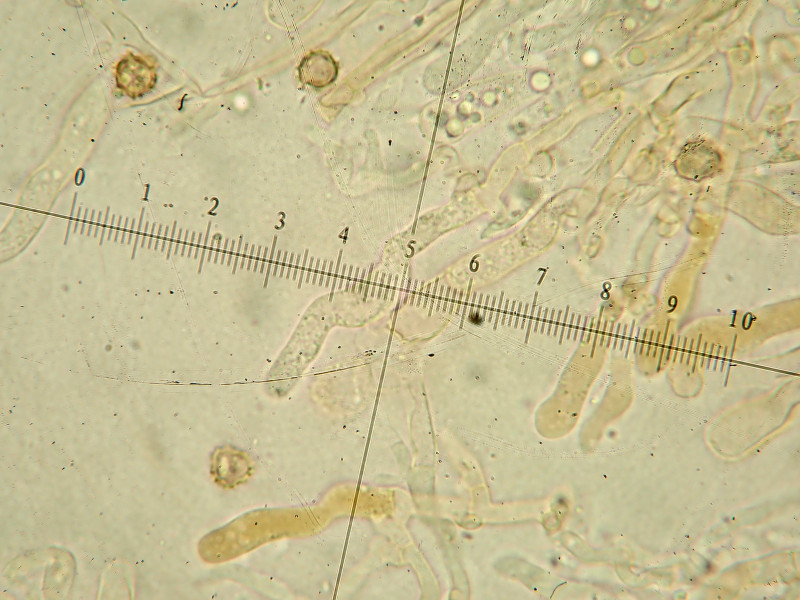
Art gewundene Skeletthyphe, mehrfach zu sehen