Hallo!
Ende Januar beim Gang durch einen Laubmischwald (Rotbuchen, Ahörner, Eschen, Eichen...) am Rande des schwäbischen Vulkans lag ein glattrindiger Laubbaum (Baumart leider unbekannt) am Waldwegesrand, der eine interessante Rindenstelle zeigte.
Eigentlich auf der Suche nach spannenden Flechten konnte ich der Versuchung nicht widerstehen, eine Rindenprobe vom oberen Stamm mit Pilzen mitznehmen.
Ich komme aber bei der Bestimmung der beiden Pilze nicht zum Abschluss. Eventuell wächst hier auch zu vieles auf- und durcheinander.

Bild 0 Liegende Laubbaumstämme

Bild 1 Rindenabschnitt mit diversen Rindensprengenden Pilzarten
Pilz 1 - Discomycet

Bild 2 Größerer inoperculater Discomycet mit weiß-filziger Außenseite und braunem (wenn angefeuchtet) Hymenium, Durchmesser um 3mm.
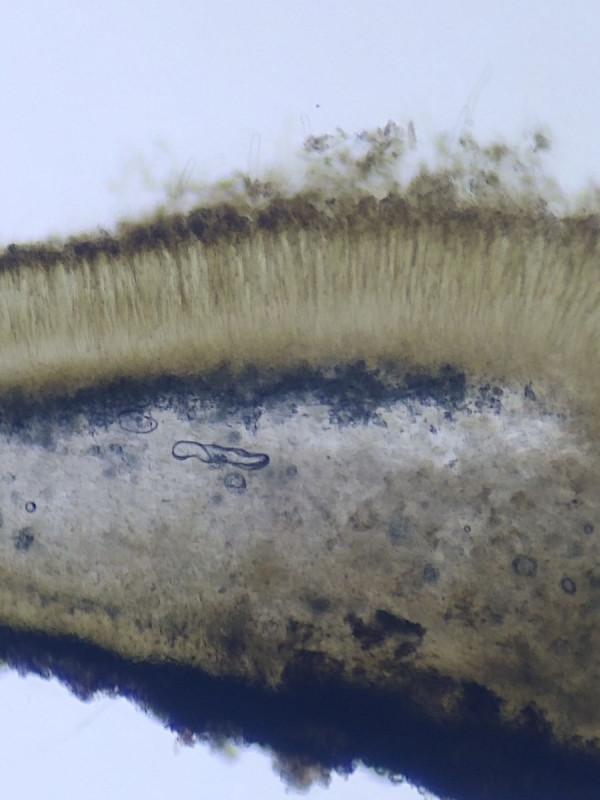
Bild 3 Epihymenium braun, Asci zylindrisch (80-110 x 6-7 µm), inamyloid, 8-sporig, unseriat
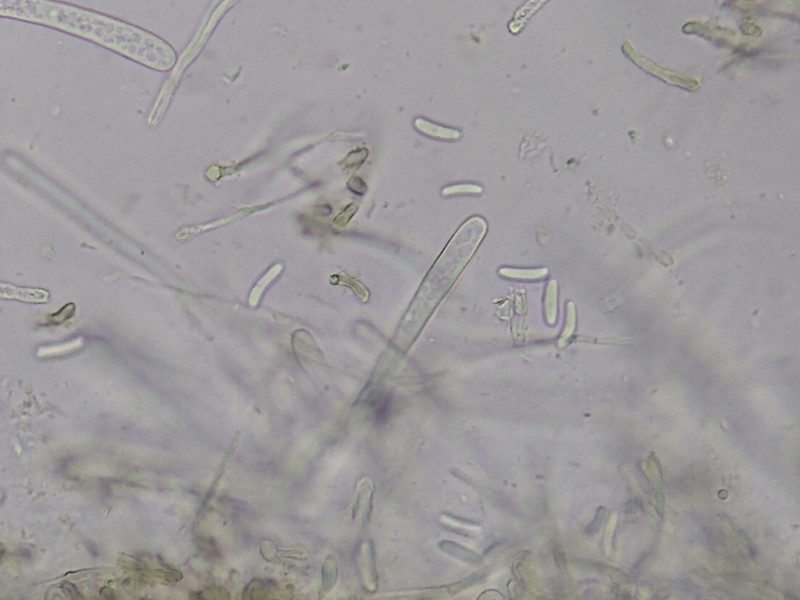
Bild 4 Sporen 1z, hyalin, leicht gebogen, um 12 x 3 µm groß.
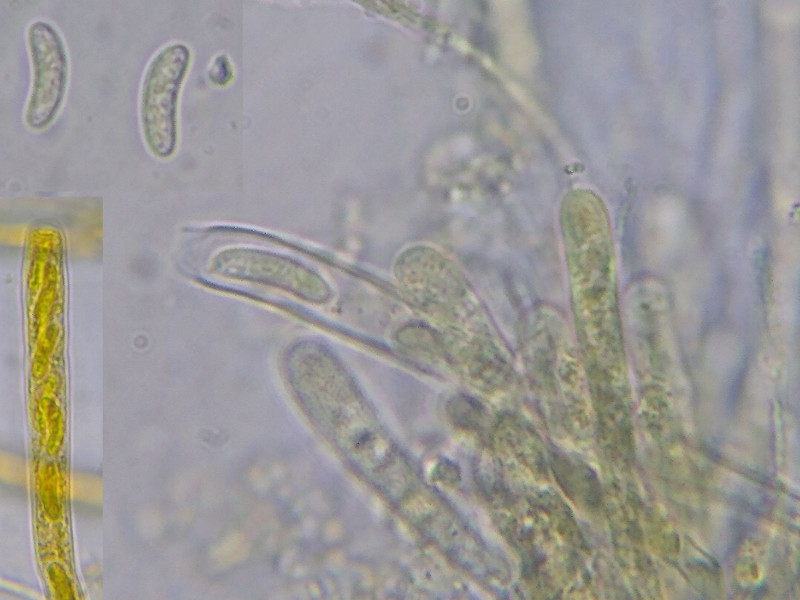
Bild 5
Die Kenntnis des Pilzes würde vermutlich die Baumart für die Bestimmung des Folgepilzes einschränken.
Ich würde zu Enchoelia tendieren, nur nach Haselnuss sieht mir der Baumstamm nicht unbedingt aus...
Pilz 2 - Anamorphe:
Interessanter finde ich eigentlich den kleinen Begleitpilz neben dem großen Discomyceten.
Es handelt sich um runde, schwärzliche, anamorphe Fruchtkörper, die unter der Rinde hervorbrechen, sternförmig aufplatzen und ein weißliches bis orangebraunes Inneres freilegen:

Bild 6 Anamorphe an gleichem Rindenstück. Die Pyknidien habe eine Größe von etwa 200-300µm.

Bild 7 Probe in Wasser, zum leichteren Ablösen der FK
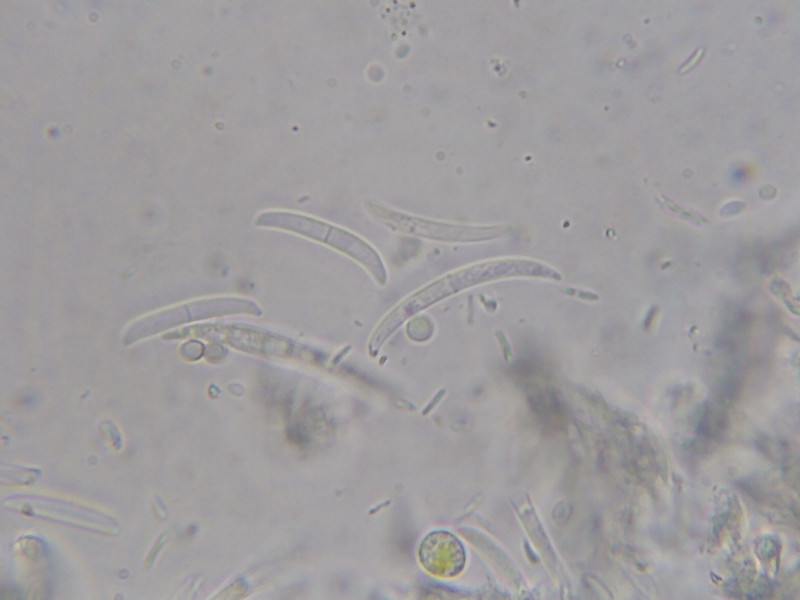
Bild 8 Im gequetschen Zustand werden 2 Typen Koniden gefunden:
Makrokonidien mit gekrümmten Spitzen à la Longhorn-Rinderhörner, 25-35 x 4 µm groß, 1-2(-4)-zellig
Mikrokonidien, Bacilliform, um 5 x 1 µm.
Können beide Konidienypen in einer einzigen Pyknidie gebildet werden?
Oder handelt es sich bei einem der Typen um Fremdmaterial?
Mehrere Pyknidien wurden geprüft, ich finde stets beide Typen.
Die Makrokonidien zumindest gehören zum Fruchtkörper, wie die gefundenen Konidienträger beweisen:
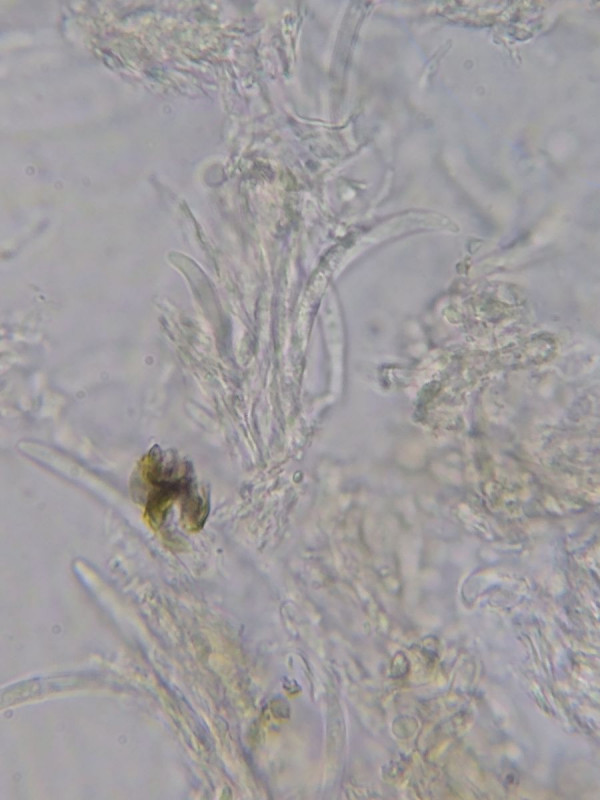
Bild 9 Konidienträger
3. Vermutlich C. nigroclavata
Ein kleines Stückchen weiter erkenne ich auf etwas warzigen Untergrund kleine, schwärzliche Apothecien.
Könnte das die Teleomorphe zu Pilz 2 sein? (Verm. nicht!)

Bild 10 Schwarze Apothecien - eventuell die Teleomorphe FK-Bildung des gleichen Rindenpilzes?
Die Apthecien sind nicht großer als die Pyknidien (300µm).

Bild 11

Bild 12
Beim ersten zarten Quetschen sind dunkelbraun pigmentierte Paraphysenköpfe zu erkennen, die kleinen Asci verstecken sich gut dazwischen.

Bild 13 Schwach angequetsches Apothecium:
Hymenium 35-40µm hoch, Epihymenium schwarzbraun durch stark pigmentierte Paraphysenköpfe (Pigmentkappe in Zellen),
Endzellen 4-5(-8) µm groß, Paraphysendurchmesser um 2µm. Paraphysen mit dunklen Septen.
Grünfärbung durch unterstreute Algenzellen - Das erinert sehr stark an Catillaria nigroclavata.
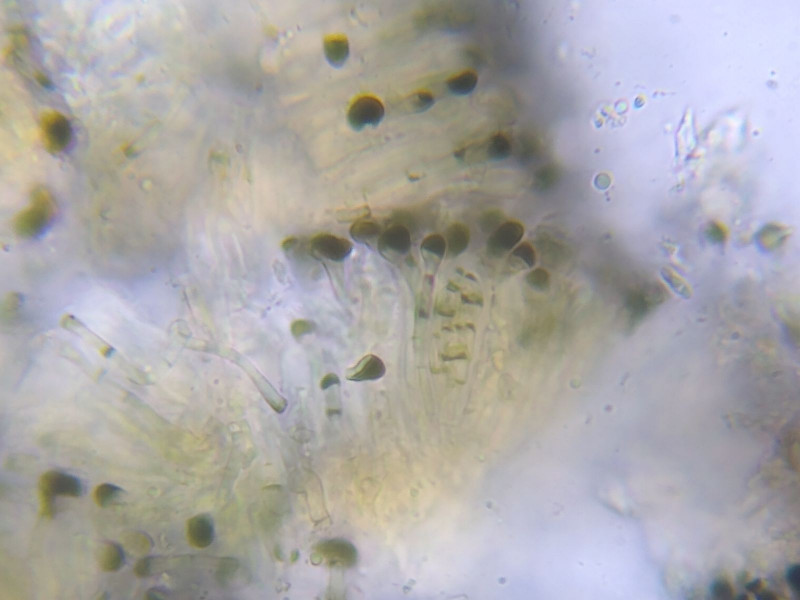
Bild 13 8-sporiger Ascus mit 2-zelligen Sporen. Die Sporen liegen in der Größenordnung von 8-10 x 3 µm.
Die Asci sind keulig verdickt und messen 25(-30) x 9 µm.
Sporenseptum dunkel, ebenso Sporenenden (?!).
Dunkle Septen bei Paraphysen und Sporen kenne ich so nicht, ansonsten schein alles (inkl. Algenzellen) zu der Flechte Catillaria nigroclavata zu passen.
Die dunklen Stellen könnten ev. auf Überalterung zurückgehen...
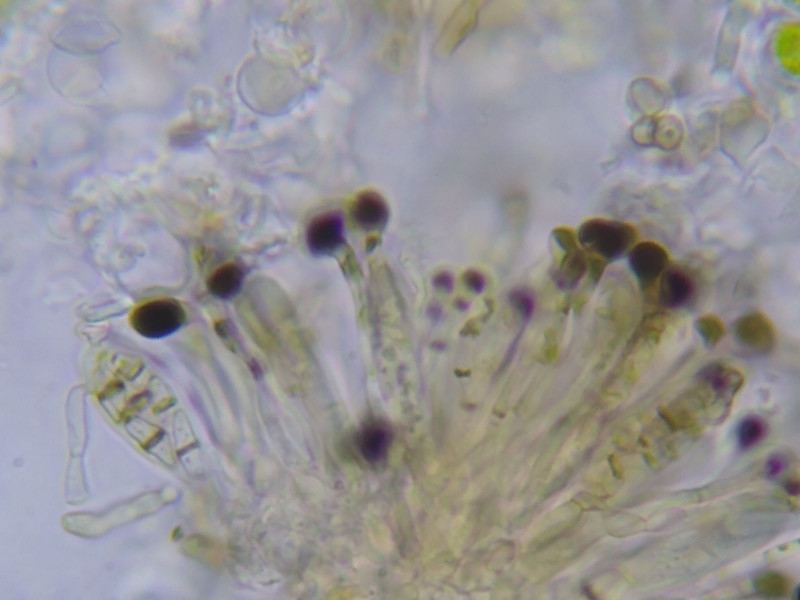
Bild 14
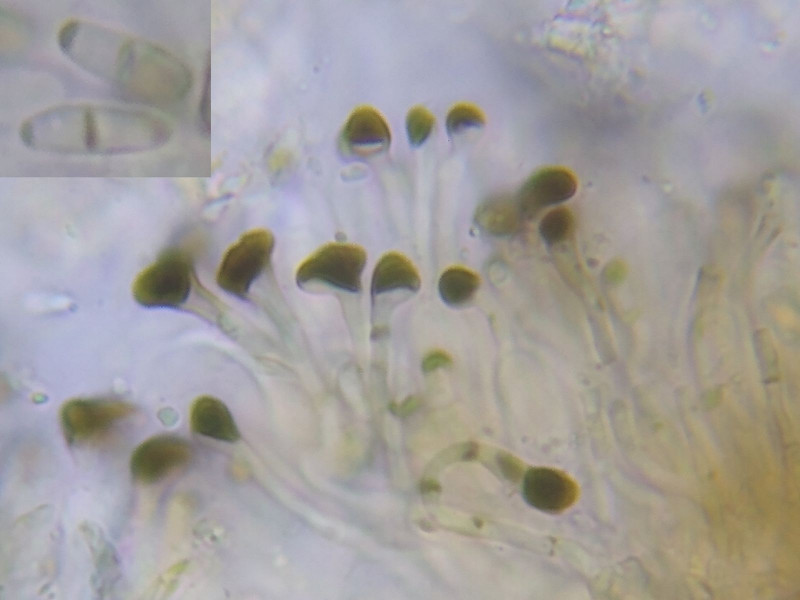
Bild 15
Ich vermute, dass die Apothecien (3) nur zufällig an der gleichen Stelle wie die Pykniden (2) wachsen, und erkenne die Flechte C. nigroclavata neben einem mir unbekannten anamorphen Pilz.
(Die Flechtenbilder lasse ich stehen, da ich mir nicht 100%ig sicher bin - Algen kommen immer und überall auf der Rinde vor. Zudem irritieren die dunklen Septen.)
Was könnte das für ein anamorpher Pilz sein? Hat jemand eine Idee dazu?
LG, Martin
![]()
![]()


