Hallo zusammen!
Ich bis diese Woche bei meinen Flechtenproben aus den Alpen auf das Probendöschen gestößen, auf das ich schon lange gespannt war.
Die zugehörige Flechte wuchs auf der wetterexponierten, etwas geneigten Oberseite eines Silikatfelsens (Glimmerschiefer o.ä.) in 2370-2380m Höhe in den südlichen Ausläufern der Granatspitzgruppe, südwestlich vom Großglockner.

Bild 1 Oben auf'm Berg ist's schöön.
Beim Hinaufkommen habe ich getrickst und auf technische Hilfsmittel zurückgegriffen (Seilbahn), denn mir ist nicht der Weg das Ziel, sondern das Obensein.
Aufgemerkt ( 
 Wenn der unkundige Laie nun meint, er blicke hier hier Berge und Felsen, so täuscht er sich.
Wenn der unkundige Laie nun meint, er blicke hier hier Berge und Felsen, so täuscht er sich.
Er blickt allerorten auf Flechten, die die Felsen und Berge überziehen und so dem direkten Blick entziehen.
Nur die Form der Felsen und Berge verrät, was sich unter dem durchgängigen Flechtenteppich verbirgt.
Nur weil viele Flechten unscheinbar gefärbt sind, fallen sie nicht weiter auf und wenden für die Steinoberfläche gehalten.
Ausnahmen bestätigen die Regel, wenn durch Verwitterung eine Steinscholle vom Fels abplatzt und die Flechten mit dem Überwachsen nicht schnell genug drüberwachsen, ehe man hinschaut.
Oder Quarz an der Oberfläche ansteht - den mögen sie nicht.
Aber zum Fund...
Fall 1

Bild 2 Hellgraue, lecideine Kruste mittig und links, rechts daneben eine ockerfarbene, schollige Kruste - um diese geht es hier.
Ich muss mich entschuldigen - hier ist tatsächlich auch mineralischer Grund zu erkennen.
Die großen Quarzadern werden meist vom Bewuchs ausgespart - wahrscheinlich zu hart und chemisch inert.

Bild 3 Nochmal etweas mehr von der Seite. Ein kleines Stückchen wird abgeknapst und eingesackt.
Es handelt sich um eine beige, schuppige Kruste.
Die Schuppen sind konvex und zeigen schwarze, meist randliche, raue Strukturen.

Bild 4 Lupenbild der Oberfläche. Die Schuppen sind 1-2mm breit, der Thallus des Probenabschnittes ist ca. 2mm dick.
Das Mark wirk seltsam zweifarbig: weiß, bereichsweise dunkler.
Immer wichtig zum Eingrenzen, die Färbetests:

Bild 5 Vergrößerter Querschnitt durch den Thallus (Algenschicht mit Grünalgen) und die wichtigsten Farbreaktionen auf Objektträger über weißem Papier.
Die Probe blutet in KOH intensiv gelb aus, dann wird die Probe orangerot.
Die Verfärbung in P geht auf eine Reaktion im Mark zurück!
Das Mark erweist sich ferner als inamyloid (ohne Bild).
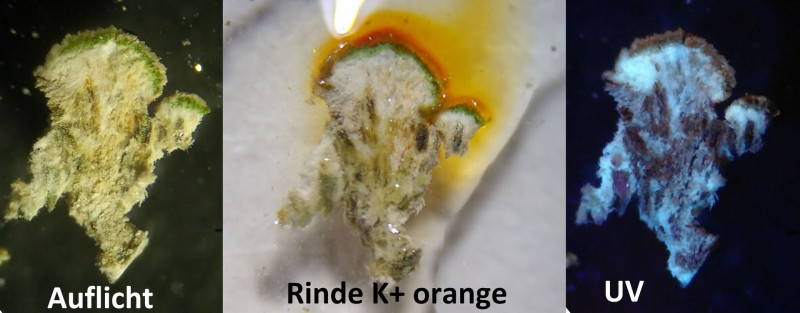
Bild 6 Unter UV-Beleuchtung sind die dunkleren Stränge im Mark besser erkennbar. Sie verlaufen nach unten und bilden eine stielartige Struktur.
Ob das schwarze Zeug am Rand der Schuppen zur Flechte gehört, glaube ich nicht.
Es lassen sich büschelartige Strukturen im Mikroskop finden, ev. gehört das zu einem anderen Pilz.
Es sind keine Isidien, keine Soredien. Fruchtkörper sind nicht zu finden.
Damit wird die Bestimmung schwierig.
Mit dem W-H-S-Schlüssel für placodioide Flechten, der Schuppenflechten mit umfasst, werde ich nach vielen Irrwegen voller Widersprüche letztlich zum Toninia-Schlüssel verwiesen.
Dort, weil auf Silikatgestein, prüfe ich den einzigen Vorschlag Psorinia conglomerata (https://italic.units.it/index.…cedure=taxonpage&num=1922).
Ich muss sagen, ganz verkehrt wirkt die Beschreibung nicht und die Fotos der sterilen Ausformung von O. Gonnet bei Italic könnten gut zum Fund passen.
Auch die Chemie ist zumindest nicht komplett verkehrt, wobei es bei Italic heißt, dass das Mark rot in KOH reagiere (ohne Belegbild), wobei hier der Cortex, nicht das Mark orangerot reagiert.
Die gleichen schwarzen Strukturen in der Fläche der Schuppen wie im Foto bei Italic finde ich genau so auf der Probe wieder.
Ich vermute Pyknidien:

Bild 7 Bildausschnitt aus Foto (ohne Beschreibung) von Pier Luigi Nimis auf der Italic-Seite (Link siehe oben); Pyknidien?
Wenn schon keine Sporenanalyse möglich ist, müssen wenigstens Pyknidien untersucht werden!

Bild 8 Vermutete Pyknidien; Bildeinsatz mit Querschnitt durch Schuppe

Bild 9 Gequetschte Pyknidie mit grünlich-schwarzer Hülle und Mengen an austretenden, stäbchenförmigen Konidien
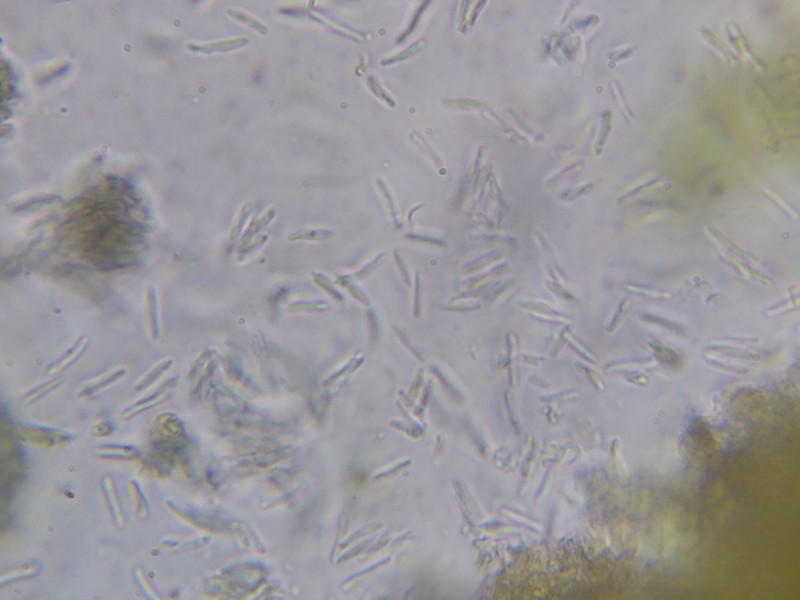
Bild 10 Bacilliforme Pyknosporen; ich messe stichprobenweise 9-11 x 1 µm.
Das liegt zwar am unteren Ende der bei Italic angegebene Längen (dort 12-20 x 1), stimmt mich aber zuversichtlicher.
Könnte also tatsächlich eine noch sterile Psorinia conglomerata sein. Aber ob es wirklich stimmt?
Fall 2
Heute dann eine weitere interessante Flechtenprobe vom gleichen Fundort, nur ein paar Meter weiter gefunden.
Unter einer Steinplatte befindet sich eine Höhlung.
In einer Tiefe von 3-4cm entfernt von der Kante, völlig regengeschützt, an der Decke sitzend, eine graue Flechte mit üppig Apothecien.

Bild 11 Flechten an Decke (?).
Ich vermute rückblickend, dass dies nicht die ursprüngliche Konstellation sein kann, da zumindest die anderen auf dem Foto sichtbaren Flechten nicht an Höhlendecken zu wachsen pflegen.
Wahrscheinlich wurde eine Steinplatte aus dem Weg geräumt und verkehrt herum auf die anstehenden Felsen neben dem Weg abgelegt, dort von mir so gefunden.

Bild 12 Ein Stück Thallus fällt mir beim Berühren der Flechte fast entgegen, etwa 20 x 15 mm groß.
Von Art der der Areolierung entfernt an Ophioparma ventosa erinnernd.

Bild 13 Die unbereiften Apothecien sitzen knäuelig, dicht gepackt auf dem Thallus auf.
Bei sehr jungen Exemplaren ist ein glänzender, schwarzer Rand erkennbar (z.B. oben links zwischen den größeren Knäueln).
Ältere Apothecien sind randlos und unförmig.
Die Thallusareolen haben konkave Gruben mit glänzender ockerfarbener Oberfläche. Die konvexen Grate der Areolen sind matt und weißlich-grau marmoriert.

Bild 14 Links: Eine ausgelöste Areole zeigt den bäumchenartigen Wuchs mit stielartiger Verlängerung.
Rechts: Medianschnitt durch die angefeuchtete Areole zeigt helles Mark auch im Stiel.

Bild 15 Farbreaktionen der Flechte an dünnen Scheiben auf Glas über weißem Papier.

Bild 16 Die K-Reaktion an einem dickeren Probenstück zeigt rote Stellen auf der Rinde (ev. länger Warten gelb => rot?)

Bild 17 Bruchkante durch Thallus mit Apothecien-Knäuel
Links: Aufsicht auf den trockenen Thallus mit schwarzen Apothecien
Mitte: Blick seitlich auf die Bruchkante auf einen etwa 1mm hohen Stapel übereinander getürmter Apothecien mit bräunlichen Rändern (trocken)
Rechts: Gleiche Stelle angefeuchtet und zur Überprüfung angeschnitten: Die braunen Stellen enthalten Hymenium und sind somit keine alten oder befallene Areolen.
Ein Dünnschnitt wurde quer durch ein planes Apothecium hergestellt.

Bild 18 Blick von oben auf schwarzes Apothecium; Dünnschnitt zur Analyse (Bild 19f)
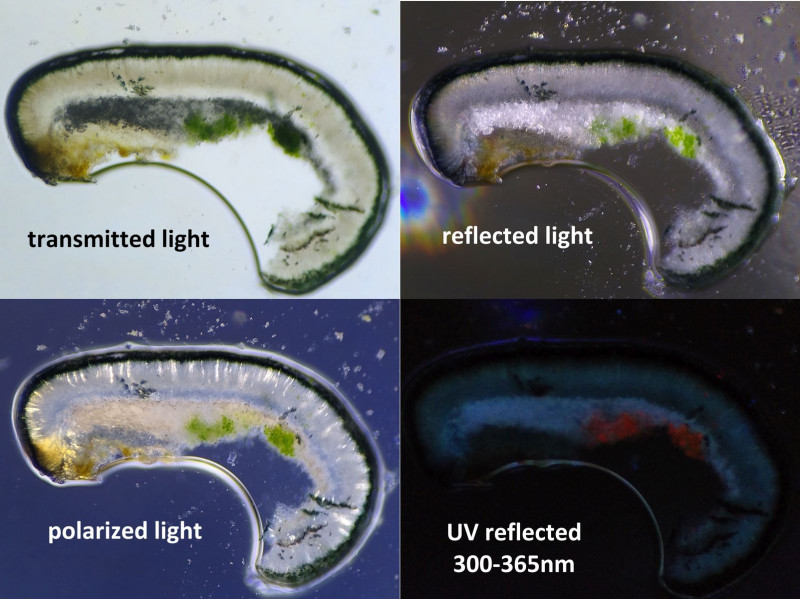
Bild 19 Dünnschnitt durch Hymenium in Wassertropfen unter dem Mikroskop.
Epihymenium tief grün bis bläulich grün, Hymenium farblos (50-65 µm dick), Hypothecium farblos (75-85 µm).
(Die hellen Strukturen im polarisierten Licht habe ich nicht weiterverfolgt, ev. Asci)

Bild 20 Asci 8-sporig, keulig, mit dickem, amyloidem Tholus. Hymenium J+ blau und K/J+ blau. Auch das Hypothecium reagiert J+blau (ohne Bild).
Zuerst erkannte ich nur 1-zellige Sporen. Jeder Bestimmungsversuch mit 1z Sporen geht in die Irre und führt zu Widersprüchen.
In Lugol und besser in BWB sind (auch) 2-zellige Sporen deutlich erkennbar.

Bild 21 Asci in Wasser; gefärbt in Lugol und in Baumwollblau. Im rechten Teilbild (BWB gefärbt) sind zweizelligen Sporen im Ascus erkennbar.
Einige frei schwimmende Sporen wurden vermessen.
Die Sporenmaße liegen bei 10-13 x 4,5-5,2 µm.

Bild 22 Sporen
Dann - mit 2-zelligen Sporen - wird die Bestimmungsarbeit wieder interessant:
Ich werde auch diesmal zum Toninia-Schlüssel verwiesen und lande - bei Psorinia conglomerata!
Schaut man genau hin, finden sich die gleichen schwarzen Pyknidien, wie bei der ersten Flechte (vgl. Bild 7) 

Bild 23 Reife Psorinia conglomerata mit Apothecien und Pyknidien
Die zweite Flechte sollte von der Bestimmung her stimmen.
Die Beschreibung und auch die Detailfotos (z.B. auch die merkwürdige und auffällige Struktur der Thallusoberfläche) bei Italic stimmen sehr gut mit den Beobachtungen hier überein.
Bei der ersten Flechte bin ich nicht 100%ig überzeugt, aber die Bestimmung erscheint mir nicht unplausibel. 
Jetzt bin ich gespannt, was ihr speziell zur ersten Flechte meint.
Zur Sicherheit könnte ich z.B. die K-Reaktion wiederholen (und hinreichend) lange warten, ob sich eine deutliche Rotfärbung einstellt, oder eben nicht.
LG, Martin
Die Beschreibung bei Italic passt sehr gut zum Fund.
Hier auszugsweise der übersetzte Inhalt:
"Thallus schuppig, locker befestigt, bis zu 4 cm groß. ...
Areolen/Schuppen, bis zu 5 mm breit, rundlich, konkav, olivbraun glänzend in den konkaven Bereichen, hellgrau bis weiß und an den Rändern matt, unbereift; ...
Obere Rinde aus dickwandigen ... Hyphen, deren Stränge bis in die Medulla reichen ... ;
Mark aus dünnwandigen, schwach verklebten Hyphen.
Apothecien oft in dichten Büscheln, glänzend schwarz, flach bis konvex und dünnen Eigenrand. ...
Epihymenium blaugrün, ...; Hymenium farblos, I+ blau;
Paraphysen verklebt, spärlich verzweigt und anastomosierend, apikale Zellen nicht oder nur leicht geschwollen;
Hypothecium farblos bis sehr blassbraun, ... I+ blau.
Asci 8-sporig, breit keulig, mit gut entwickeltem, amyloidem Tholus, Okularkammer, breite Axialmasse; Lecanora-Typ.
Ascosporen 1-zellig bis selten 1-septiert, hyalin, schmal ellipsoid, 9-18 x 4-6 µm.
Pyknidien flächig, versenkt, mit ... schwarzem Ostiolus. Konidien fadenförmig, ... 12-20 x c. 1 µm. ...
Färbeproben: oberer Kortex K+ gelb, C-, KC-, P+ gelb; Mark K+ gelb, rot, C-, KC-, P+ orange.
Eine arktisch-alpine, zirkumpolare Art, die auf steil geneigten bis regengeschützten Oberflächen von saurem bis leicht basischem Silikatgestein vorkommt, oft in Spalten und Rissen; am häufigsten oberhalb der Baumgrenze in den Alpen, wo sie die nivale Zone erreicht."
Quelle: https://italic.units.it/index.…cedure=taxonpage&num=1922


