Hallo zusammen,
ich habe gestern (15.10.2021) einen Täubling gefunden und natürlich mitgenommen. Jedoch komme ich bei ihm auf keinen Fall voran und bin mir nicht mal mit einer Sektion sicher. Ich habe den Täubling auf einer Dachterrasse der Ruhr-Universität Bochum gefunden und war sehr verwundert. Weit und breit kein Baum, nur einzelne Birkensämlinge und auf der anderen Seite des Weges eine kleine Kiefer... was macht ein Täubling hier?
Mein Problem ist es, die merkwürdigen Zellen in der HDS zu identifizieren. Sie verfärben sich weder in SV noch in Karbolfuchsin + Salzsäure, jedoch scheinen sie inkrustiert zu sein. Sie sind genauso wie die Huthauthaare sehr klein und die meisten Bilder hier sind 1000x.
Kommen wir mal zu den Daten:
Hut: 5cm d; Rand ist gerieft
Steil: 4cm lang; 13mm d an der dicksten Stelle; gilbt stark!
Geruch: erst nach nichts, später leicht süßlich, an R. fellea erinnernd
Geschmack: Fleisch und Lamellen mild, lediglich Lamellen ganz junger Frk deutlich scharf (hat mich echt verwundert)
Guajak: St & L +++
FeSO4: hell rosa/pfirsichfarbend
restliche Chemikalien unbedeutend mE
Sporenpulverfarbe: IIIc
1

2

Die Sporen haben verbundene Ornamente:
3
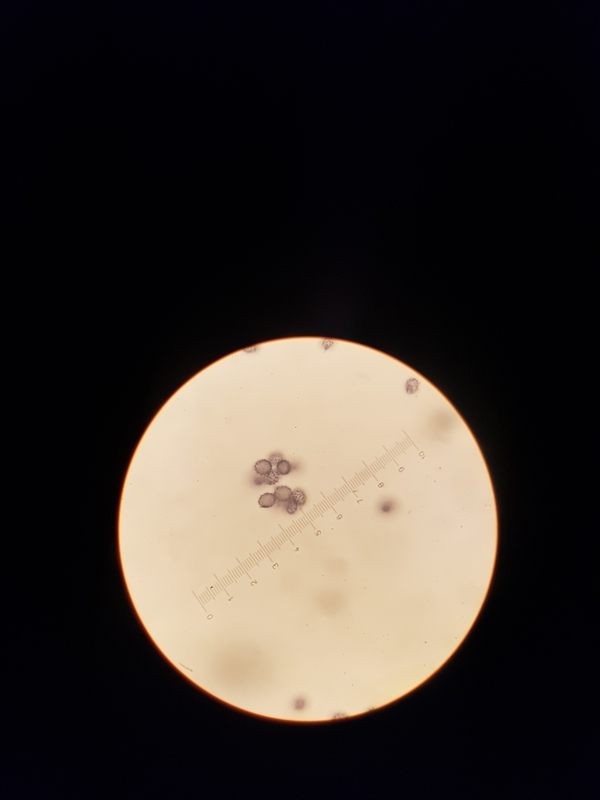
4

Und hier die dazugehörigen Messungen:
# Länge Breite Q. Fläche (L*B)
[µm] [µm] [µm²]
---------------------------------------------------
1 5,44 4,7 1,16 25,57
2 6,3 5,03 1,25 31,69
3 6,39 5,03 1,27 32,14
4 4,86 4,52 1,08 21,97
5 5,7 4,86 1,17 27,7
6 5,87 4,98 1,18 29,23
7 6,26 4,85 1,29 30,36
8 4,86 4,46 1,09 21,68
9 5,3 4,16 1,27 22,05
10 5,41 4,84 1,12 26,18
11 5,49 4,52 1,21 24,81
12 5,01 4,8 1,04 24,05
13 5,81 5,2 1,12 30,21
14 4,51 4,15 1,09 18,72
15 5,24 4,62 1,13 24,21
---------------------------------------------------
min 4,51 4,15 1,04 18,72
max 6,39 5,2 1,29 32,14
mittel 5,5 4,71 1,16 26,04
Jetzt kommen wir zur HDS. Alle Bilder 1000x
5
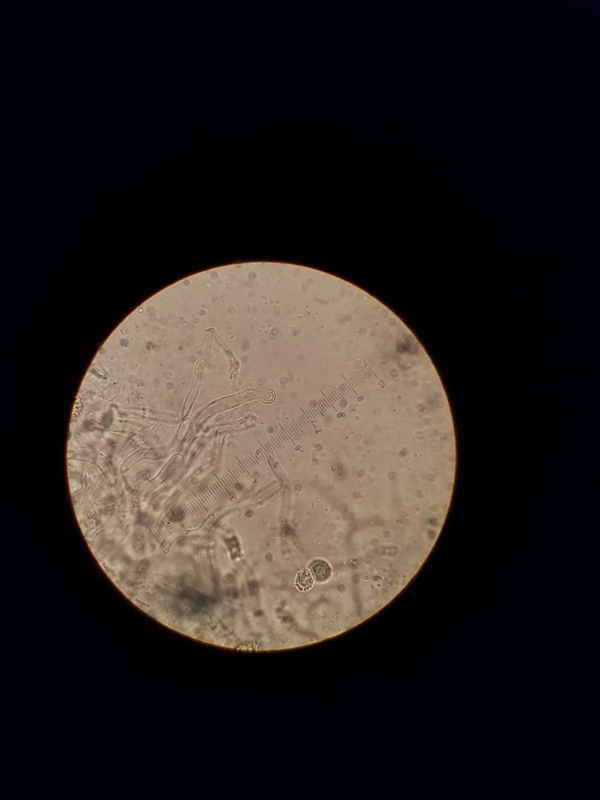
6
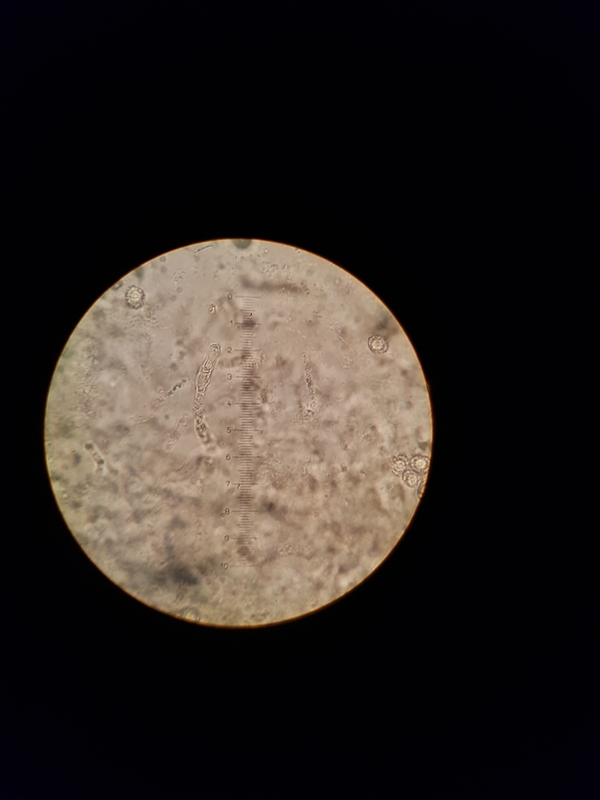
7

8

9

10

11
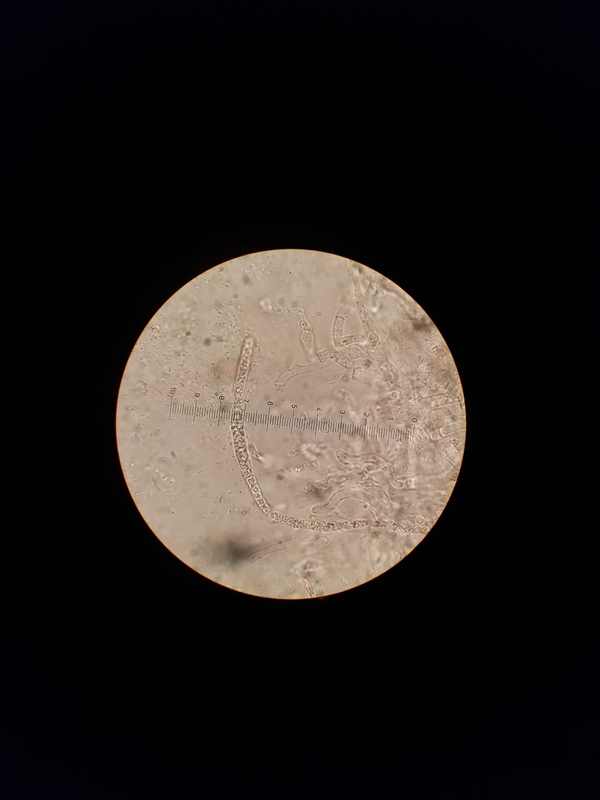
12
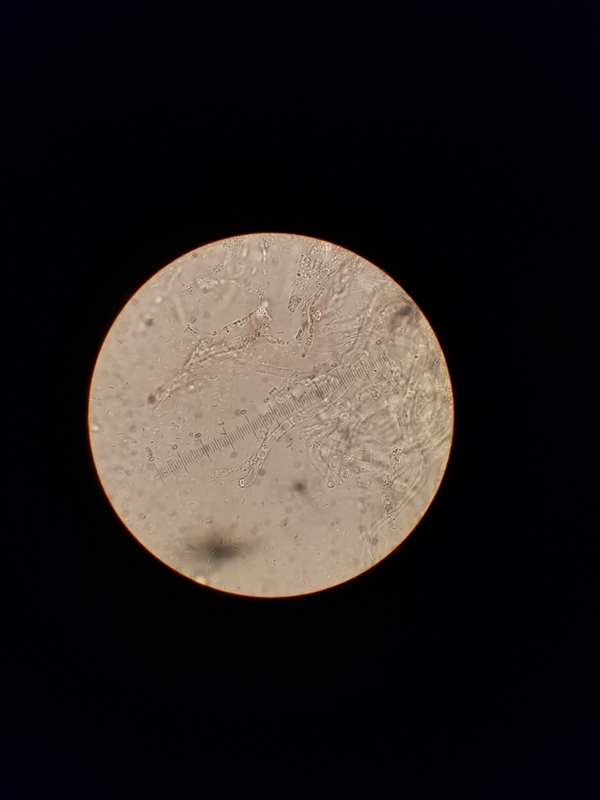
In den Bildern 5, 10, 11 und 12 sind, denke ich, Epikutishaare zu sehen. Und der Rest? Ich habe erst auf inkrustierte PileoZ getippt, denke aber, dass das doch inkrustierte Primoridalhyphen sind. Aber weder SV noch Karbolfuchsin haben geholfen. Stutzig macht es mich auch, dass alles so klein ist. Unter 450x zwar zu sehen, aber ganz anders, als bei den vorherigen Täublingen, die ich untersuchen durfte.
Ich hoffe, ihr könnt mir weiterhelfen und erklären, was ich da sehe.
Viele Grüße und Danke im Voraus
Oliver


