Hallo zusammen,
ich möchte euch einen Fund vorstellen der mir im Moment Kopfzerbrechen bereitet.
Auf einer nicht mehr ganz jungen Eiche fand ich gestern reichlich kleine Apothecien von ca. 1 mm Länge und "Kaffebohnen"-artiger Gestalt die mich zunächst an etwas aus dem Kreis Opegrapha denken ließen (erste Überlegung O. atra).
Die Ap sind unbereift und scheinen manchmal von einem grauen Lager umgeben. Beim schlüsseln (nach WHS) komme ich zu Hysterium pulicare u.A. da das Hymenium nicht oberflächlich blau ist. Bei weiterer Beschäftigung dann zu Hysterium angustatum da die Sporengröße deutlich unter der für H. pulicare beschriebenen liegt. In der Umgebung liegen reichlich Algen, insb. auch Trentepohlia sp. (die hier aber im Moment massiv an den Bäumen "blühen") und auch andere Grünalgen sodass ich einen richtigen Flechtenthallus nicht ausmachen kann. Die Ap. sind aber gut von einem grauen Schleier umgeben.
Lichens marins - Hysterium angustatum Alb. & Schw. ex. Mér.
https://fungi.myspecies.info/all-fungi/hysterium-angustatum
Soweit so gut, findet sich aber in einer zweiten Probe ein (makroskopisch) etwas deutlicheres Lager mit kleinen schwarzen Punkten die ich erstmal für Pyknidien halten würde, sich für mich aber mikroskopisch nicht so sicher fassen lassen. Die Ap. sind hier auch deutlich kleiner und in der Quetschprobe kommt ein konfuses Bild raus. Hier weiß ich nicht was ich davon halten soll. Zudem hatte ich gesehen, dass Hysterium sp. nur in Kultur anamorphe Formen mit Pyknidien bilden sollen.
Könnt ihr meine Einordnung zum ersten Teil nachvollziehen oder bin ich auf dem Holzweg und stehe doch vor einer Opegrapha sp?
Was haltet ihr von der zweiten Probe?
Vielen Dank schon einmal und viele Grüße
Peter



(1A,B,C) Haufenweise kleine schwarze längliche Apothecien in Borkenrissen von Eiche. Teilweise von grauem Schleier umgeben (A), teilweise nicht (B).
Probe durch das Stereomikroskop (C).

(2) Querschnitt durch eine Apothecium mit reichlich pigmentierten Sporen und geschlossenem Excipulum. Epihymenium ohne für mich wahrnehmbare Farbe und auch ohne K-Reaktion. Im Randbereich teils reichlich Algen. Wilde mischung aus Trentepohlia sp. und was anderem (Chlorococcus?).
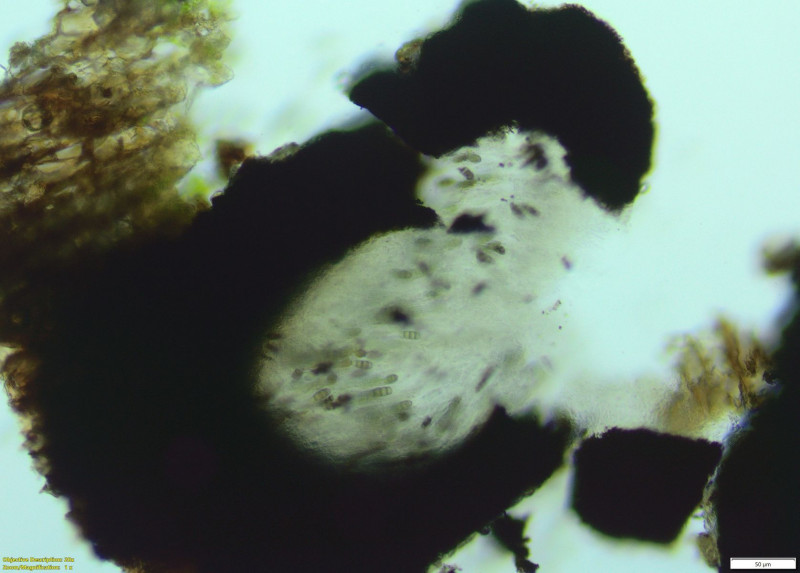
(3) Weiterer Querschnitt

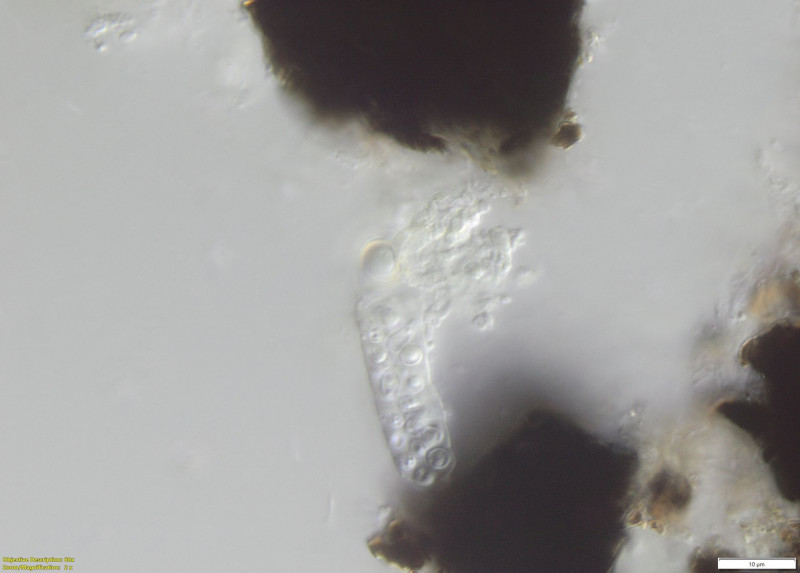
(4) Sporen

(5) Hymenium I+ rot (in Wasser). Epihymenium farblos bis grau.


(6) Die zweite Probe, Übersicht (A) udn Detial (B).

(7) Schnitt durch einen kleinen schwarzen Punkt

(8) Kleiner schwarzer Punkt (DIC, Wasser)

(9) Kleiner schwarzer Punkt in LCB
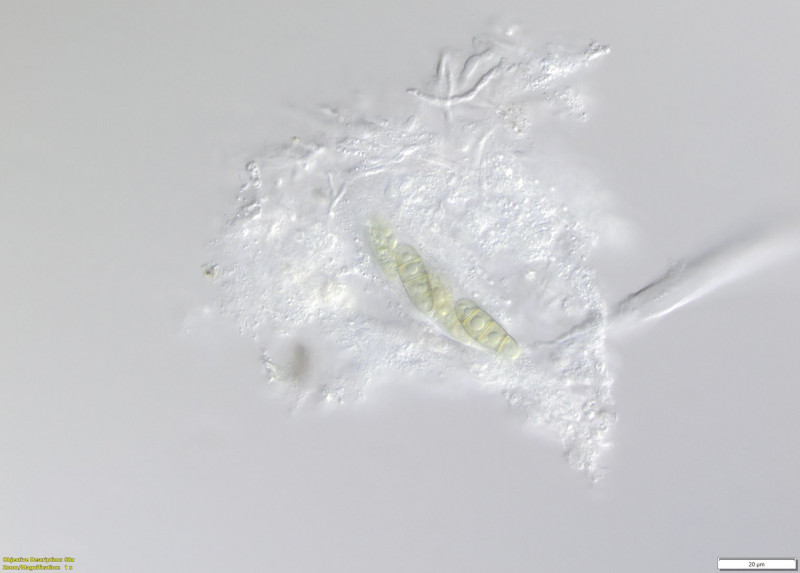
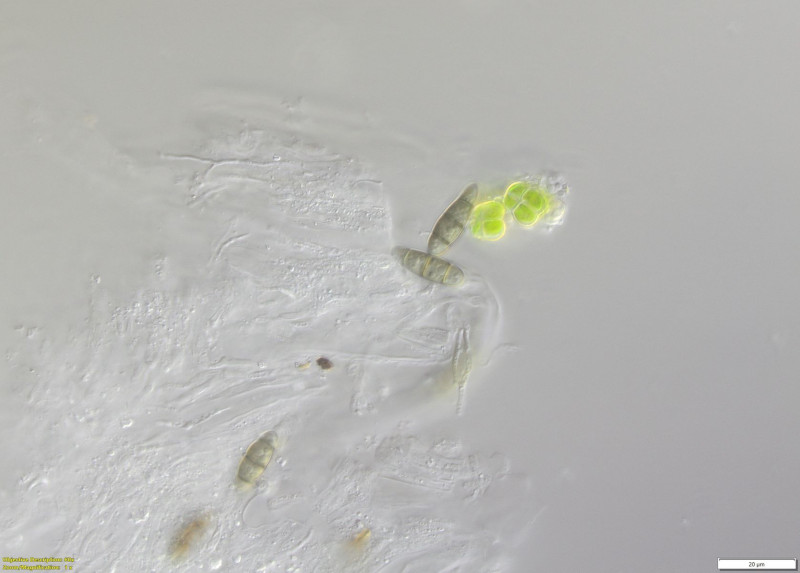
(10-15) Quetschpräparate durch Apothecium 2. Probe (Wasser)
(11) (Wasser)
(12) (Wasser)

(13) (Wasser)
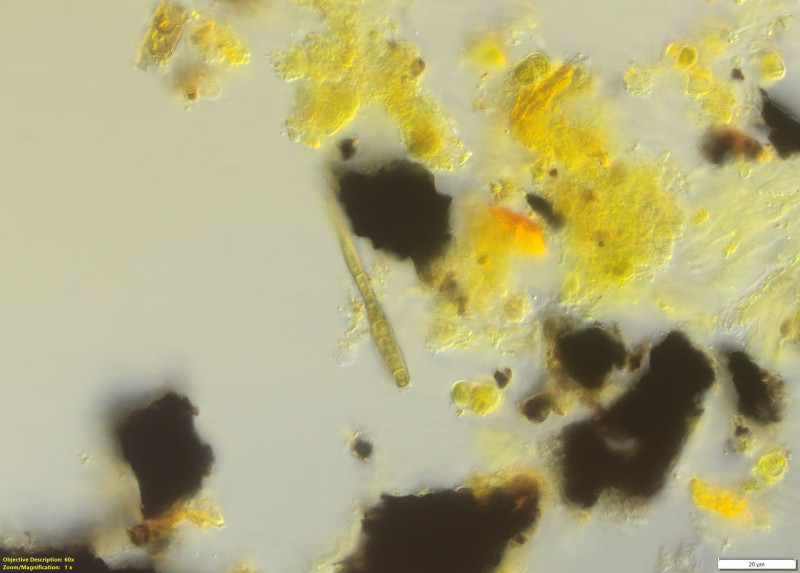
(14) (in I) fungi.myspecies.info schreibt "one ascospore had dimensions of 45 x 11 µm" ggf. liegt hier auch eine Riesenspore vor.
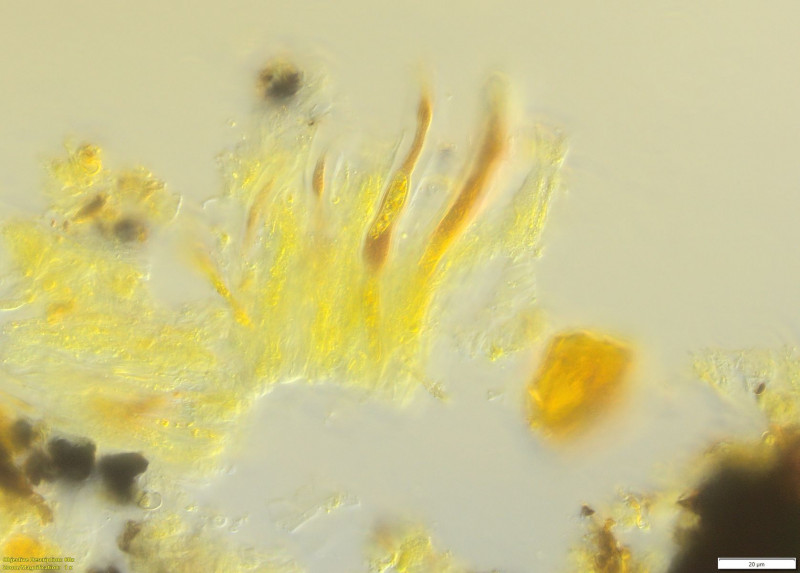
(15) (in I)

(16) Habitat: eine Eiche an der Böschung zum Mittellandkanal in Hannover. Vermehrt im Regenschatten.


