Liebe Pilzfreunde,
in diesem Beitrag möchte ich die Histologie des Pilzes Scleroderma citrinum Pers. (Dickschaliger Kartoffelbowist) vorstellen. Mikroskopische Aufnahmen der Sporen dieses Pilzes sind hier schon mehrfach gezeigt worden. Im Folgenden sollen nicht nur Sporenpräparate, sondern der gesamte Vegetationskörper des Pilzes an Paraffin- und Kunststoffschnitten, aber auch an KOH-Quetschpräparaten vorgestellt werden.
Vor einer histologischen Besprechung soll zunächst eine kurze Beschreibung des Pilzes erfolgen. Scleroderma citrinum gehört zur Unterabteilung der Basidiomycotina, der Klasse Gasteromycetes (Bauchpilze), der Familie Sclerodermataceae und der Gattung/Art Scleroderma citrinum (systematische Einordnung entnommen aus dem Lehrbuch: Allgemeine Mykologie, Herbert Weber, 1. Aufl., 1993). In Abbildung 1 wird eine Freilandaufnahme des reifen Pilzes an seinem natürlichen Standort und nach einer Erdaushebung gezeigt. Der Pilz besitzt einen nahezu runden Fruchtkörper (Gastero-thezium) mit einem Durchmesser von 6 bis 12 cm. Kennzeichnendes Merkmal von Scleroderma citrinum ist eine ein- bis zweischichtige, dickschalig-ledrige Peridie, die an der Oberfläche grobschuppig, rotbraun gezeichnet ist (Exoperidie). Bei dem hier gezeigten Pilz ist eine Zwillingsbildung (rechts unten) zu beobachten. Der Pilz ist mit Hyphensträngen (–žWürzelchen–œ, siehe Abb. 1B) am Substrat befestigt. Ob dem hier ausgehobenen Pilz eine Mykorrhiza vorliegt, kann nicht beantwortet werden.

Abb. 1: Freilandaufnahme von Scleroderma citrinum mit Zwillingsbildung, A vor-, B nach einer Aushebung
Wird der reife Fruchtkörper quer zerteilt und die Hälften stereoskopisch gesichtet, wird ein Blick auf das hymeniale Gewebe (gastrales Basidioma) erhalten. Da sich der Fruchtkörper von Scleroderma citrinum angiokarp entwickelt, bleiben die Sporen bis zur ihrer endgültigen Reife von der dickwandigen Peridie umschlossen. Erst nach Abschluss der Reife öffnet sich die Peridie durch Rissbildung und entlässt die Basidiosporen ins Freie (Ausstauben). Die sporenbildende Hyphenmasse wird als Gleba bezeichnet. In Abbildung 2 wird ein Anschnitt der Gleba gezeigt. Die Gleba gliedert sich in Glebakammern, die im Zustand der Reife mit Basidiosporen gefüllt sind. Die Kammern werden untereinander durch Tramaplatten-/-stränge (steriles Mycel) voneinander getrennt. Die mit reifen Sporen gefüllten Glebakammern zeichnen sich durch eine tiefschwarze Farbe mit leicht violettem Stich aus. Die Basidien von Scleroderma citrinum befinden sich nicht in einem geordnetem Hymenium, sondern liegen locker eingestreut in Hyphengeflechten der –žGlebakammern–œ. Die Holobasidien sind schmal-keulenförmig und tragen 4 bis 6 Meiosporen. Diese sitzen auf zum Teil lang ausgezogenen Sterigmen und werden passiv abgetrennt (sog. Statismosporen). Die sporentragenden Basidien sind nur an frühen Fruchtkörpern (Farbwechsel des Fruchtfleiches von gelb nach schwarzbraun) zu beobachten.

Abb. 2: Anschnitt des Fruchtkörpern von Scleroderma citrinum (Gl Gleba, Pe Peridie, sGk sporengefüllte Glebakammer, Tr Tramastränge)
Das Hyphensystem von Scleroderma wird als trimitisch beschrieben. Es soll aus generativen Hyphen, Skelett- und Bindehyphen bestehen. Aufgrund des fortgeschrittenen Reifezustandes und der damit verbunden Teillyse der Gleba ist im vorliegenden Falle keine sichere Zuordnung der Hyphen mehr möglich. Im Folgenden sollen Hyphen verschriebener Abschnitte des Pilzes beschrieben werden, die sich morphologisch deutlich voneinander unterscheiden lassen (KOH-Quetschpräparation).
Die Vegetationsperiode des Pilzes reicht von Juli bis November. Aber auch im Dezember können noch geschlossene, reife Fruchtkörper gefunden werden. Die in diesem Beitrag histologisch verarbeiteten Pilze wuchsen auf einem pH-saurem, kalkarmen Boden eines Kiefernbestandes (Pinus sylvestris; pH-Wert 4,75). Alle verarbeiteten Pilze befanden sich in einem reifen Zustand.
Mikroskopische Untersuchung des Pilzes Scleroderma citrinum
Vor einer Beschreibung der mikroskopischen Anatomie des Pilzes Sclerderma citrinum sollen zunächst die in diesem Beitrag verwendeten Abkürzungen alphabetisch aufgelistet werden. Hierbei ist eine Trennung zwischen Bildbeschrif-tungen und Zonierungen in Bildern vorgenommen worden:
Abkürzungen der Bildbeschrifungen
AdGk...........Anlage der Glebakammer
aHr.............anhaftende Hyphenreste
aPp.............abgelöster Protoplast
Ar...............Arthropodenrest
bMy............basales Mycel
dSp............degenerierte Spore
eA.............epidermale Ausscheidungen
eMy...........einwachsendes Mycel
Fg.............Fraßgang
Gl..............Gleba
Gk.............Glebakammer
iSw............innere Sporenwand
HdG...........Hphen der Glebakammern
Hr.............Hohlraum
LdFg..........Lumen des Fraßganges
lHr.............lytisch gebildeter Hohlraum
lMy............lockeres Mycel
lR..............lytisch enstandener Spaltraum
Lu.............Lumen
MdP..........Mycel der Peridie
My............Mycel
n-wO........netzig-warzige Ornamentierung
Ol............Oleifere
Pe............Peridie
RdB..........Reste der Basidien
RdFg.........Rand des Fraßganges
Sg...........Subgleba
sGh..........sklerifizierte Generativhyphe
sGk..........sporengefüllte Glebakammer
Sn...........Schnalle
Sp...........Spore/n
tHg..........teillysiertes Hyphengeflecht
Tr............begrenzende Tramastränge
wHy.........weitlumige Hyphe
zGl...........zusammengefallene Gleba
Abkürzungen der Zonierungen
Ba...........Pilzbasis
Ds...........lockere Deck-(–žHut–œ)-schicht
Ed...........Endoperidie
eMy........einwachsendes Mycel
Ex1/2......äußerer und innerer Abschnitte der Exoperidie
Fk...........Fruchtkörper
Gl...........Gleba
LdF.........Lumen des Fraßganges
Sg..........Subgleba
Sub.........Substrat
vMy........verdichtetes Mycel
(an dieser Stelle sei empfohlen, die Auflistung auszudrucken und zum Vergleich den folgenden Abbildungen beizulegen)
1. Untersuchung eines reifen Fruchkörpers von Scleroderma citrinum
In Abbildung 3 wird eine mikroskopische Aufnahme eines Querschnittes durch den nahezu reifen Fruchtkörper von Scleroderma citrinum gezeigt. Zentral ist die Gleba zu erkennen, deren Kammern durch Tramastränge voneinander getrennt sind. Umgeben wird die Gleba von einer Peridie, die an den Flanken dickwandig und gut färbbar, apikal aber dünnschichtig ausgebildet ist. Im oberen Abschnitt des basalen Anteiles des Pilzes befindet sich der Bereich der Sub-gleba, die im vorliegenden Falle Fraßgänge aufweist.

Abb. 3: Übersichtsaufnahme eines Querschnittes des nahezu reifen Fruchtkörper von Scleroderma citrinum
Wird die Gleba bei höherer Vergrößerung betrachtet, ist die durch Tramastänge begrenzte, kammerartige Gliederung deutlich zu erkennen (Abb. 4). In den Kammern sind reife Sporen sowie Sporen, die ihre Entwicklung nicht vollenden konnten, zu beobachten. Der Anteil an degenerierten Sporen in den Kammern kann auf einem Wert von 5% geschätzt werden. Die umgebenden Tramastänge sind in einer schleimigen Matrix eingebettet, die sich durch Fuchsin leicht rosa anfärbt.

Abb. 4: Aufnahme der in Kammern gegliederten Gleba
In Abbildung 5 wird eine Detailaufnahme einer Glebakammer gezeigt. Die intensiv rot angefärbten Sporen werden von einer teillysierten, schleimigen Matrix umschlossen, bei der es schwer fällt, einzelne Hyphenstränge zu verfolgen. Be-sonders deutlich wird der Zerfall bei einer mikroskopischen Betrachtung im Phasenkontrast. Skeletthyphen, die der Lyse wiederstehen müssten, konnten in den hier untersuchten Kammern nicht beobachtet werden. Bei einer Betrachtung der Sporen ist die netzig-warzige Ornamentierung zu erkennen. Des Weiteren fallen randständige, weitlumige Hyphen auf, die in Ein- oder Mehrzahl in allen Kammern vorhanden sind. Der Durchmesser dieser Hyphen beträgt im Mittel 28,4 µm. Die scharfe Randbegrenzung der weitlumigen Hyphen schließt aus, dass es sich um lysigen gebildete Hohlräume handelt. Auf die Besonderheit dieser Hyphen soll bei der Behandlung des –žHyphensystemes–œ noch einmal eingegangen werden.
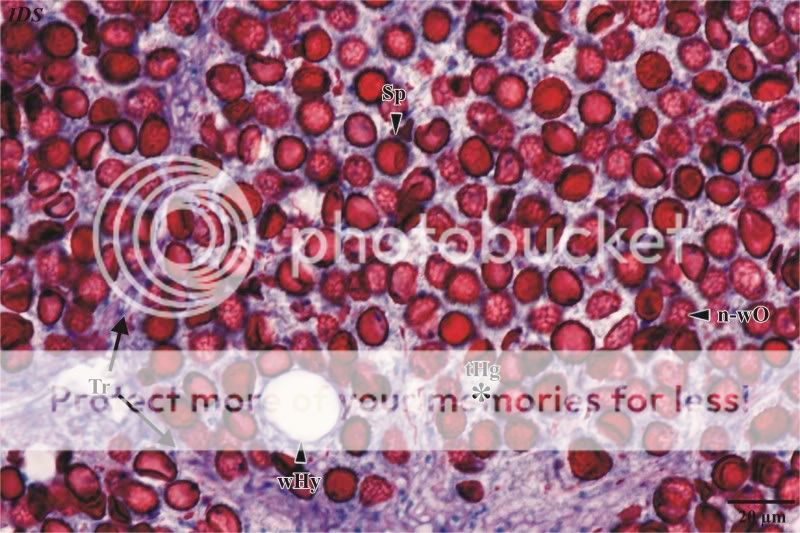
Abb. 5: Detailaufnahme einer Glebakammer (beachte die weitlumigen Hyphe)
Richtet sich der Blick auf den Bereich kurz unterhalb der Peridie, sind auch hier weniger deutlich abgegrenzte Gleba-kammern zu beobachten (Abb. 6). In den Kammern befinden sich eine erheblich geringere Anzahl vollständig ausge-bildeter Sporen. Es überwiegen deformierte/degenerierte Sporen sowie mit Fuchsin tiefrot anfärbbare Hyphen (Abb. 7). Werden die Hyphen bei hoher mikroskopischer Vergrößerung betrachtet, ist an Wenigen zu erkennen ist, dass es sich
um degenerierte Basidien handelt.

Abb. 6: Aufnahme des Bereiches unterhalb der Peridie
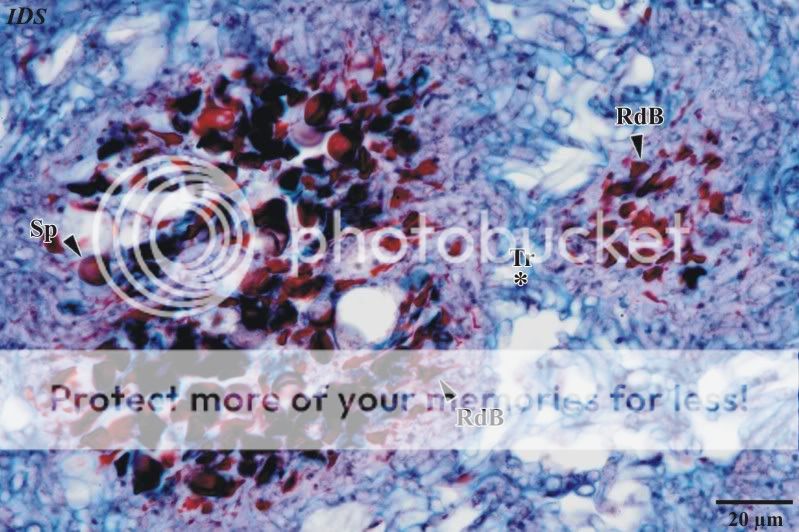
Abb. 7: Detailaufnahme einer Kammer des Bereiches unmittelbar unterhalb der Peridie
Gleiche Verhältnisse zeigen sich auch bei den Kammern im Bereich der Subgleba (medianer bis teilbasaler Anteil des Pilzes; siehe Abb. 8). Die Glebakammern sind auch hier nicht scharf begrenzt, enthalten in der Mehrzahl Sporen in degradiertem Zustand und zeichnen sich durch gut anfärbbare, –žzerstreut liegende–œ Reste der Basidien aus. Soll der Zustand dieser Kammern im Vergleich zu Kammern der zentral liegenden Gleba bewertet werden, ist zu vermuten, dass ein stofflicher Gradient dafür sorgt, dass die dezentralen Lokalitäten der Fruktifikation einer Hemmung unterliegen oder in der Reife nicht gefördert werden (gleiches ist auch bei einer Zwillingsbildung zu beobachten, sie unten).
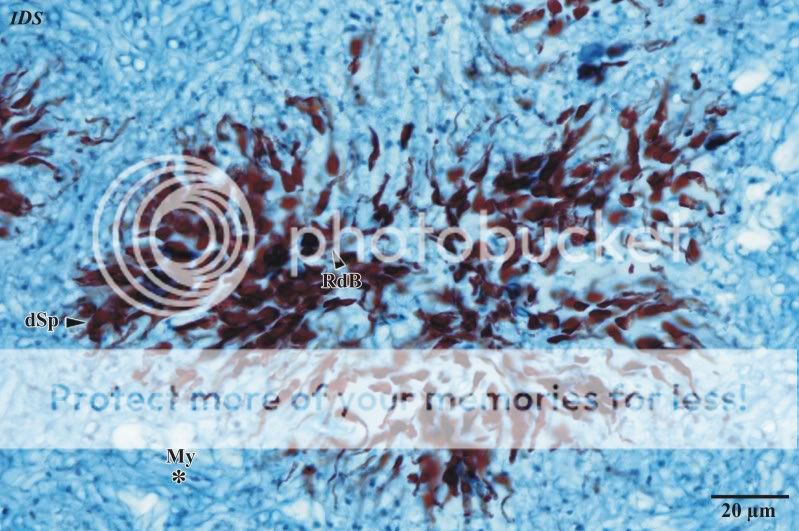
Abb. 8: Detailaufnahme einer Kammer im Bereich der Subgleba
Auf die Subgleba folgt der basale, stielartige Abschnitt des Pilzes, der mit seiner Unterseite über –žWürzelchen–œ mit dem Substrat (hier: dem Waldboden) verbunden ist. Wird eine Detailaufnahme dieses Pilzbereiches aufgenommen, zeigt sich, dass das Mycel weitmaschig verwoben ist und sich durch mittel- bis weitlumige Hyphen auszeichnet (Abb. 9). Die Merk-male dieser Hypen lassen den Schluss zu, dass ihnen eine wesentliche Aufgabe beim Transport von Wasser und Nährstoffen zufällt.
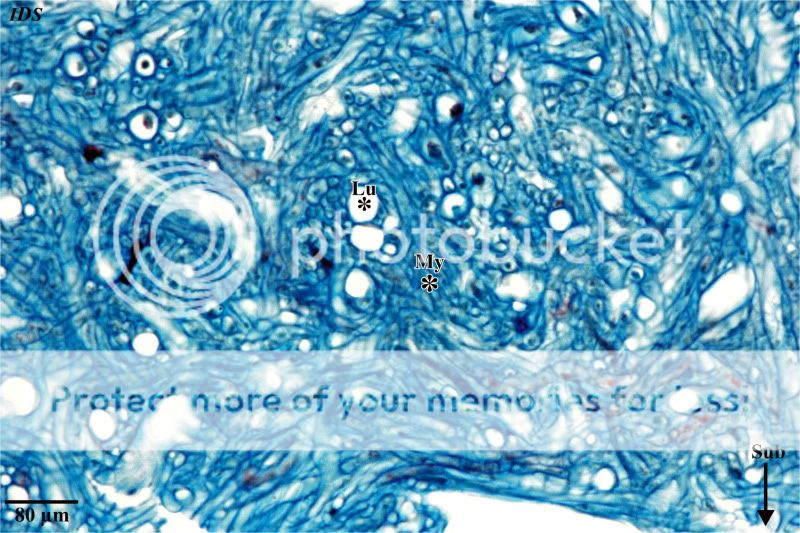
Abb. 9: Hyphengeflecht des basalen, dem Substrat aufsitzenden Bereich des Pilzes Scleroderma citrinum
Bei einer mikroskopischen Durchmusterung des basalen Pilzabschnittes fallen Hyphen auf, die nicht erkennbar septiert sind und einen Durchmesser von 25 bis 30 µm besitzen (Abb. 10). Werden diese Hyphen in Beziehung zu den weit-lumigen, quer angeschnittenen Hyphen der Glebakammern gesetzt, ist eine deutliche, morphologische Übereinstimmung festzustellen. Da im Lumen dieser Hyphen nur geringe organische Reste zu beobachten sind, ist zu vermuten, dass ihnen die Aufgabe zufällt, Wasser zu den Orten der Fruktifikation zu leiten.

Abb. 10: Weitlumige, nicht septierte Hyphe des basalen Pilzbereiches
Nachdem die verschiedenen Abschnitte des Pilzes vorgestellt wurden, soll noch einmal auf den Reifegrad der Gleba eingegangen werden. Die Lyse, die im Geflecht der Glebakammern stattfindet und die Sporen, die in einer teillysierten Matrix einbettet sind, wurden bereits beschrieben. Bei der histologischen Verarbeitung fallen Schnitte auf, die dem des Bildes der Abbildung 11 entsprechen. Teile der Gleba erscheinen als großer Hohlraum. Diese Hohlräume entstehen als wandständige oder zentrale Ablösungen der Gleba bei gleichzeitiger, fortgeschrittener Lyse.
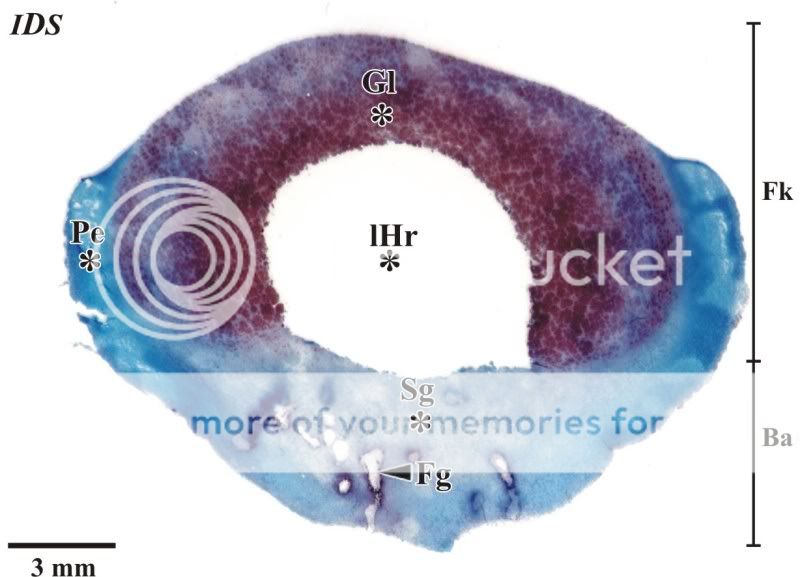
Abb. 11: Übersichtsaufnahme eines Querschnittes eines reifen Fruchtkörpers mit Hohlraumbildung
Die Lyse führt zur Trennung zwischen den Tramasträngen und vereinzelt die Glebakammern. Da sich auch in den Gleba-kammern das Hyphengeflecht durch Lyse auflöst, werden die Sporen in die Lage versetzt, nach Aufriss des Frucht-körpers –žausstauben–œ zu können. In Abbildung 12 wird eine Aufnahme vom Randbereich der lytischen Zone gezeigt. Hierbei lässt sich die lytische Trennung im Bereich der Tramastränge, aber auch die fortgeschrittene Lyse der Gleba-kammern selbst beobachten.
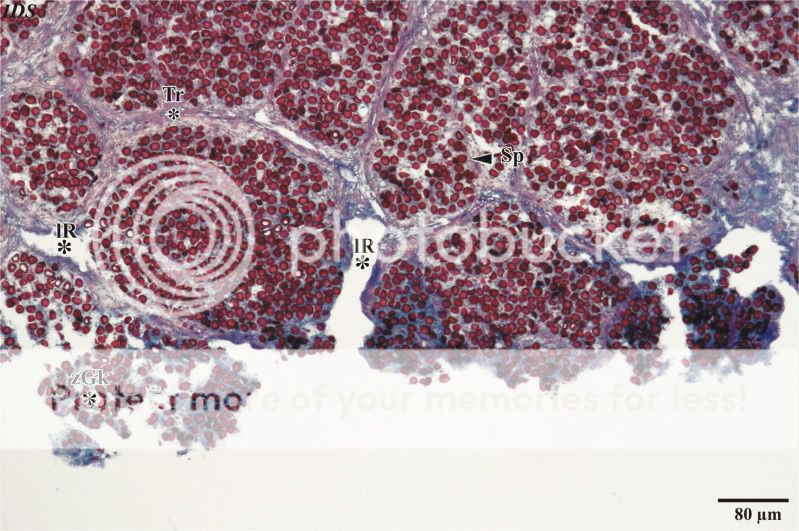
Abb. 12: Aufnahme eines lytisch veränderten Abschnittes der Gleba
2. Beschreibung auffälliger Hyphen von Scleroderma citrinum
Im folgenden Abschnitt sollen Hyphen mit auffälligen Merkmalen beschrieben werden. Es wurden bereits weitlumige Hyphen beschrieben, die vom basalen Abschnitt des Pilzes bis zu Glebakammern führen und und vermutlich für eine Wasserversorgung der Kammern verantwortlich sind. Des Weiteren fallen an der Oberfläche des Pilze grobschuppige, rotbraun gezeichnete, warzige Bereiche auf. Wird Material dieser –žWarzen–œ abgenommen und zu Quetschpräparaten verarbeitet, sind neben generativen Hyphen auch Hyphen mit gelbbraunem Inhalt zu beobachten. Das Erscheinungsbild dieser Hyphen entspricht am ehesten denen von Oleiferen (siehe Abb. 13A). Die Nester dieser Oleiferen werden von dickwandigen, generativen Hyphen (GH) mit Schnallen an den Septen unterlagert. Die Dickwandigkeit weist auf sklerifizierte, generative Hyphen hin (Abb. 13B). Wird Randmaterial der Glebakammern in Kalilauge zu Quetsch-präparaten verarbeitet, sind stark verzeigte, schnallentragende Hypen zu erkennen (Abb. 13C). Der Durchmesser dieser Hyphen ist nur etwa halb so groß wie der, der zuvor beschriebenen sklerifizierten Generativhyphen. Die Morphologie dieser Hyphen entspricht denen von Bindehyphen (BH). Leider ist eine Zuordnung schwierig, da die Gleba in einem fortgeschrittenen Lysestadium vorliegt. Typische Skeletthyphen, die nach Literaturangabe dem Prozess der Lyse widerstehen müssten, konnten in den hier gesichteten Quetschpräparaten nicht beobachtet werden. Wird die Peridie genauer mikroskopisch betrachtet, fallen schmale, langstreckig verlaufende und wenig verzweigte Hyphen auf, die sich mit Fuchsin intensiv rot anfärben (Abb. 13D). Vermutlich handelt es sich auch bei diesen Hyphen um einen Typ von Oleiferen.
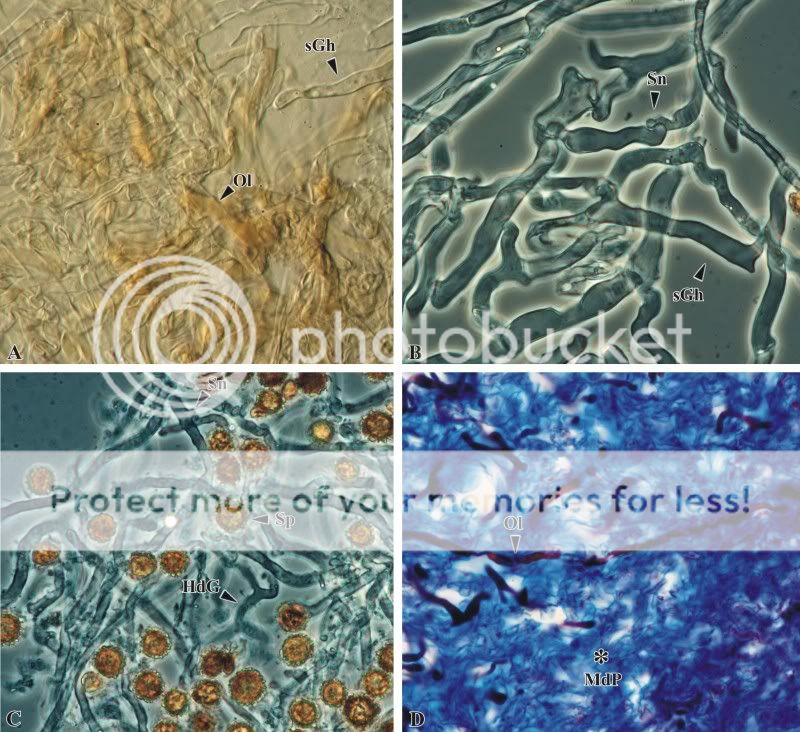
Abb. 13: Aufnahmen von Hyphen des Pilzes Scleroderma citrinum in Quetsch- und Schnittpräparaten, A Oleiferen an der Oberflächer der Peridie, B sklerifizierte, generative Hphen der Peridie, C Bindehyphen der Glebakammern, D abstei-
gende Oleiferen der Peridie
3. Beschreibung der Sporen von Scleroderma citrinum
Nachdem die Hyphen des Pilzes Scleroderma citrinum beschrieben wurden, sollen nun die Sporen besprochen werden. In Abbildung 14 wird ein mit Lactophenol-Baumwollblau gefärbtes Einschlusspräparat der Sporen gezeigt. Das Mycel der Glebakammern ist vollständig aufgelöst. Die nahezu runden Sporen sind dunkelbraun gefärbt und zeichnen sich durch eine netzig-warzige Ornamentierung der Oberflächen aus (Abb. 14A). Wird Sporenmaterial nach einer Paraffineinbet-

Abb. 14: Aufnahmen der durch Lyse freigelegten Sporen von Scleroderma citrinum
tung geschnitten (siehe Abb. 5), erscheinen die Sporen leer oder enthalten nur wenige protoplasmatische Reste. Im Unterschied hierzu bleibt bei der Kunststoffschnitttechnik der Protoplast erhalten. In Abbildung 15B wird ein 2 µm dicker Schnitt durch eine Spore gezeigt. Hierbei wird ein Blick auf die Sporeninnenwand und den in diesem Falle abgelösten Protoplasten erhalten. An der äußeren Ornamentierung haften Reste lysierten Hyphenmateriales. Ein Zellkern oder Zellkerne konnten nicht beobachtet werden. Nach Literaturangaben soll die Primärhyphe bereits im dikaryotischen (haploiden Zweikern)-Status keimen. Zum Abschluss der mikroskopischen Sporenuntersuchung wurde eine Größenbe-stimmung vorgenommen. Hierbei wurde ein mittlerer Durchmesser von 9,8 µm, ein minimaler von 8,2 µm und ein maximaler Wert von 11,3 µm ermittelt (bitte beachte, dass es sich um nahezu runde Sporen handelt). Der mittlere Durchmesser von 9,8 µm fällt für Sporen von Scleroderma citrinum etwas zu niedrig aus. Diese Abweichung ist sicher auf die Art der Messung zurückzuführen. Hierbei wurden die Sporen bei 1450-facher Vergrößerung unter Beachtung der Maßgabe, dass die abstehende Ornamentierung nicht mit erfasst wird, vermessen.
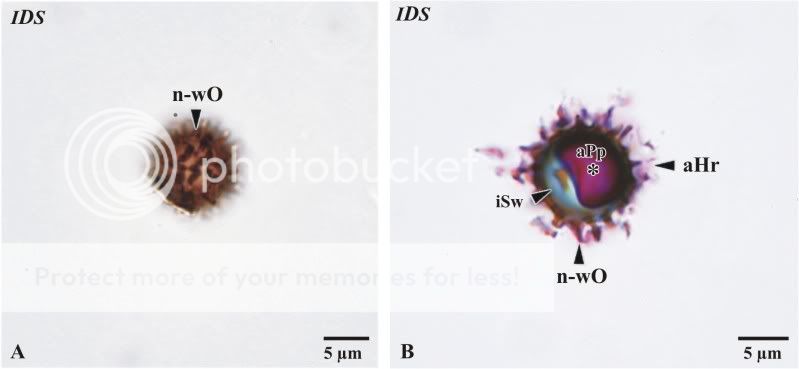
Abb. 15: Detailaufnahmen der Sporen von Scleroderma citrinum; A native Spore, B Dünnschnitt durch eine Spore
4. Mikroskopische Untersuchung der Zwillingsbildung von Scleroderma citrinum
In Abbildung 1 wurde eine Freilandaufnahme des Pilzes Scleroderma citrinum gezeigt. An der unteren, rechten Seite des Pilzes ist ein Auswuchs zu beobachten. Dieses Auswuchs ist hier als Zwillingbildung bezeichnet worden. Im Unterschied zum Mutterpilz besitzt die Zwillingsbildung keine –žWürzelchen–œ und ist somit nicht als eigenständiger Pilz zu betrachten. In Abbildung 16 werden makroskopische Übersichtsaufnahme einer quer aufgeschnittenen Zwillingsbildung gezeigt. Wird ein seitlicher Anschnitt betrachtet, lässt sich eine dickwandige Peridie von einer prospektiven Gleba und einer Subgleba unterscheiden (Abb. 16A). Eine Kammerung der Gleba sowie eine Füllung der Kammern mit schwarzbraunen Sporen ist nicht zu beobachten. Bei einer medianen Schnittführung durch die Zwillungsbildung zeigt sich, dass der –žGlebasack–œ zusammengefallen ist und sich einseitig an die Peridie angelagert hat (Abb. 16B). Die makroskopischen Beobachtungen lassen vermuten, dass es bereits im Frühstadium der Fruktifikation zu einem Abbruch und einer Degeneration der Gleba gekommen ist.
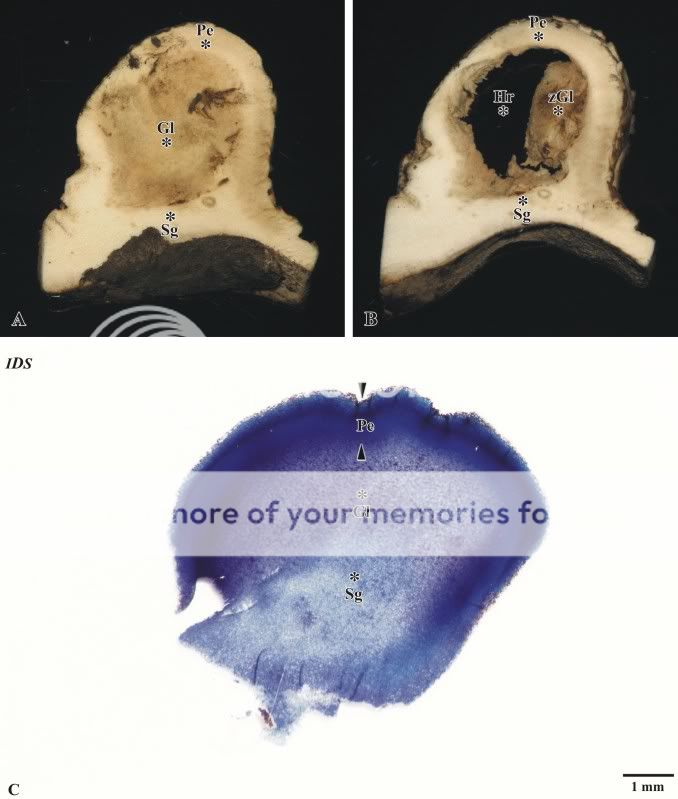
Abb. 16: Makroskopische und mikroskopische Aufnahmen einer Zwillingsbildung, A seitlicher-, B medianer
Anschnitt der Zwillingsbildung, C histologischer Schnitt durch die Zwillingbildung
Um den Entwicklungstand der Gleba genauer beurteilen zu können, wurde eine Zwillingsbildung histologisch bearbeitet. In Abbildung 16C wird eine Übersichtsaufnahme eines entsprechenden Schnittes gezeigt. Auf eine Peridie folgt eine prospektive Gleba, die von einem Anteil der Subgleba unterlagert wird. Wie bereits beschrieben, zeigen sich bei der Gleba der Zwillingsbildung nicht die typischen Merkmale des reifen Zustandes des Mutterpilzes. Bei hoher mikros-kopischer Vergrößerung ist ein lockeres Mycel zu erkennen, in das nesterartig die Anlagen der Glebakammern einge-streut sind. Die Bildung scharf begrenzender Tramasträngen fehlt noch. In den Nestern lassen sich mikroskopisch keine Basidien beobachten. Auffällig sind Hyphen, die sich mit dem Fuchsinanteil des Farbstoffgemisches intensiv rotbraun anfärben. Wird das mikroskopische Bild dieser Gleba mit Aufnahmen von dezentral liegenden Glebakammern des Mutterpilzes verglichen, ist eine hohe Übereinstimmung zu beobachten (vergleiche Abb. 17 mit den Abb. 7 und Abb. 8). Im Unterschied zu Letzteren sind in der Gleba der Zwillingbildung keine Sporen vorhanden. Ob der Abbruch der Gleba-entwicklung des Zwillings auf eine hemmende Wirkung des Mutterpilzes oder auf das nahende Ende der Vegetations-periode des Pilzes zurückzuführen ist, kann nicht sicher entschieden werden. Auffällig ist jedoch, dass alle zum Ende der Vegetationsperiode gesammelten Pilze das gleiche Reifestadium aufwiesen, sich aber hinsichtlich ihrer Größen deutlich voneinander unterschieden. Die Frage, auf welche Weise eine derartige Synchronisation stattfindet, kann hier nicht beantwortet werden.
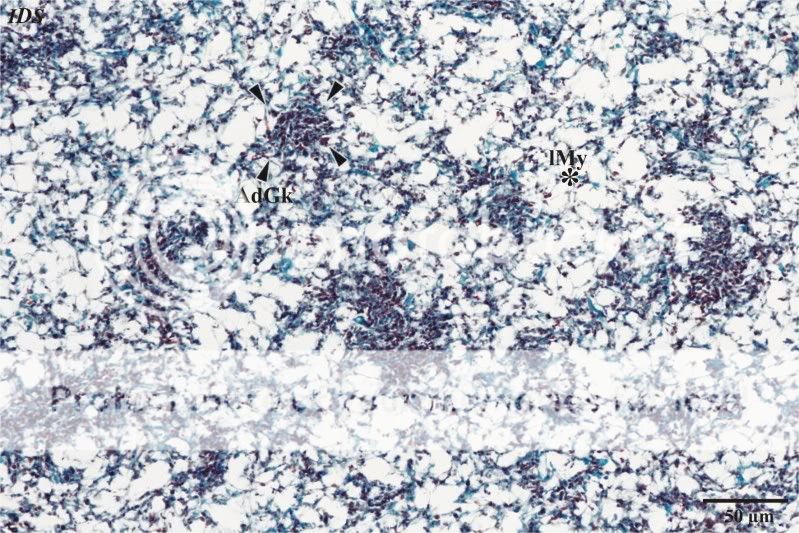
Abb. 17: Detailaufnahme der Gleba der Zwillingsbildung
Nach einer Studie der Gleba wurde die Peridie im Detail mikroskopisch untersucht. Im Unterschied zum Mutterpilz lässt sich die Peridie der Zwillingbildung nach einer Kombinationsfärbung in verschiedene Abschnitte unterteilen (siehe Aufnahme der Abb. 18). Auf ein loses, in Teilen abgelöstes Mycel der Deckschicht (entspricht der –žHuthaut–œ der hyme-nialen Basidioma) folgen ein lockeres hellblau gefärbtes und ein kompakt ausgebildetes, tiefblau gefärbtes Mycel. Diese Mycelanteile sind wohl der Exoperidie zuzuordnen. In die Tiefe folgt ein weiteres, weniger tiefblau gefärbtes Mycel mit hoher Geflechtdichte (Endoperidie). Hierauf folgt die prospektive Gleba. Der Übergang zwischen beiden Schichten verläuft unscharf. Sollen die Beobachtungen am Zwilling auf den Mutterpilz übertragen werden, ist zu ver-

Abb. 18: Aufnahme eines Querschnittes durch die apikalen Bereich der
Peridie des Zwillings
muten, dass die Peridie des reifen Fruchtkörpers im Wesentlichen von Anteilen der Endoperidie bedeckt wird (vergleiche Abb. 18 mit Abb. 3). An einer weiteren Untersuchung soll der Aufbau der Peridie des Zwillings mit der sich entwickelnden Peridie des Mutterpilzes verglichen werden (siehe Abschnitt –žAusblick–œ).
5. Mikroskopische Untersuchung von Fraßgängen im Bereich der Subgleba
Im Bereich der Subgleba sind weitlumige Hohlräume zu erkennen. Diese Hohlräume fallen bereits bei der histologischen Übersichtsaufnahme der Abbildung 3 auf. Werden die Hohlräume bei höherer Vergrößerung mikroskopisch untersucht, wird deutlich, dass es sich um Fraßgänge handelt. An den –žWänden–œ der Fraßgänge sind blau angefärbte, epidermale Ausscheidungen zu beobachten. Des Weiteren enthalten viele Hohlräume Reste eines Arthropoden. Hierbei ist zu ver-muten, dass zunächst der Fraßgang, vermutlich durch einen Nematoden, angelegt wurde und anschließend ein Arthro-pode (eine genauere Bestimmung ist an den Resten nicht möglich) gefolgt ist.
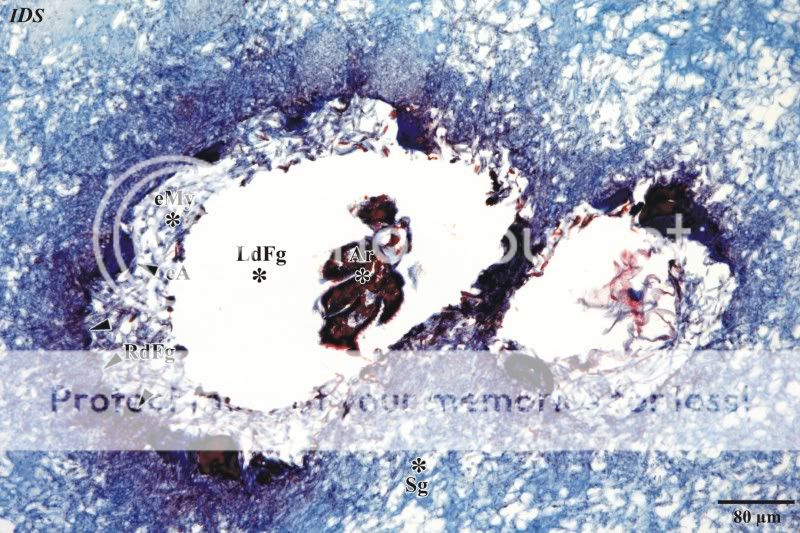
Abb. 19: Übersichtsaufnahme eines Fraßganges mit Resten eines Arthropoden
Um die Reaktion des Pilzes auf den Fressfeind genauer beschreiben zu können, wurde die Begrenzung des Fraßganges bei höherer Vergrößerung untersucht. Von Seiten der Subgleba bildet der Pilz ein begrenzendes, kompaktes und dicht verwobenes Mycel aus (siehe Abb. 20). Die Hyphen zeichnen sich durch rot anfärbbare Einschlüsse (Defensine?) aus. Material der aufliegenden, epidermalen Ausscheidung des Fraßfeindes wird von Hyphen durchwachsen. Aber auch von nicht belegten Abschnitten wachsen Hyhen aus dem begrenzenden, kompakten Mycel hervor und setzen sich in das Lumen des Fraßganges fort. Wie bei den Hyphen der Begrenzung zeichnen sich auch die einwachsenden Hyphen durch rot anfärbbare Einschlüsse aus.

Abb. 20: Detailaufnahme der Begrenzung des Fraßganges mit einwachsendem Mycel
In Abbildung 21A wird eine Aufnahme gezeigt, bei dem das gesamte Lumen des Fraßganges durch eine lockeres Mycel geschlossen wurde. Die randständigen, epidermalen Ausscheidungen sind durchwachsen, aber nicht abgebaut worden. Dies könnte an enthaltenen Scleroproteinen liegen, die einem Abbau entgegen wirken. Die Hpyhen selbst zeichnen sich durch eine rote Anfärbbarkeit aus. Bei weiterer Durchmusterung der Subgleba sind Fraßgänge zu entdecken, die voll-ständig durch ein dichtes Mycel geschlossen wurden. Der Randbereich der ehemaligen Fraßgänge mit anliegendem,
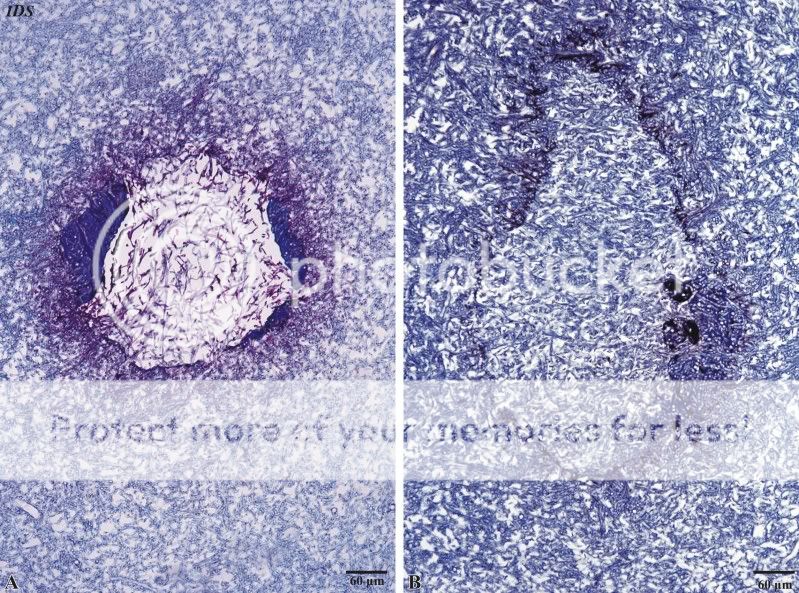
Abb. 21: Früher und später Zustand von Fraßgängen nach einer Reaktion des Pilzes Scleroderma citrinum
epidermalem Ausscheidungsprodukt ist deutlich in Form einer –žNarbe–œ zu erkennen. Die Affinität zu Fuchsin ist verloren gegangen, so dass das füllende Mycel ein für die Subgleba typisches Färbeverhalten zeigt. Die Frage, ob und bis zu welchem Reifegrad der Pilz Scleroderma citrinum in beschriebener Weise auf einen Fraßfeind reagieren kann, lässt sich hier nicht beantworten.
Ausblick
In der vorliegenden Untersuchung wurden Pilze verarbeitet, bei denen sich die Fruchtkörper im reifen Zustand am Ende der Vegetationsperiode befanden. Im Rahmen eines ergänzenden Beitrages sollen Pilze gesammelt und verarbeitet werden, an denen die frühen Bildungs- und Entwicklungsstadien der Peridie und der Gleba (Sporenbildung an Basidien) beobachtet werden können.
Anmerkung: Die hier beschriebene systematische Einteilung des Pilzes Scleroderma citrinum entspricht nicht dem aktu-ellen Wissensstand, hebt aber den Unterschied der gastralen zur hymenialen Organisation besonders deutlich hervor.
Ich wünsche viel Freude beim Lesen dieses Beitrages!
Dieter


